“LEBER CONJENİTAL AMAUROUSİS” HASTALIĞINDA CRISPR GEN TEDAVİSİ YÖNTEMİ
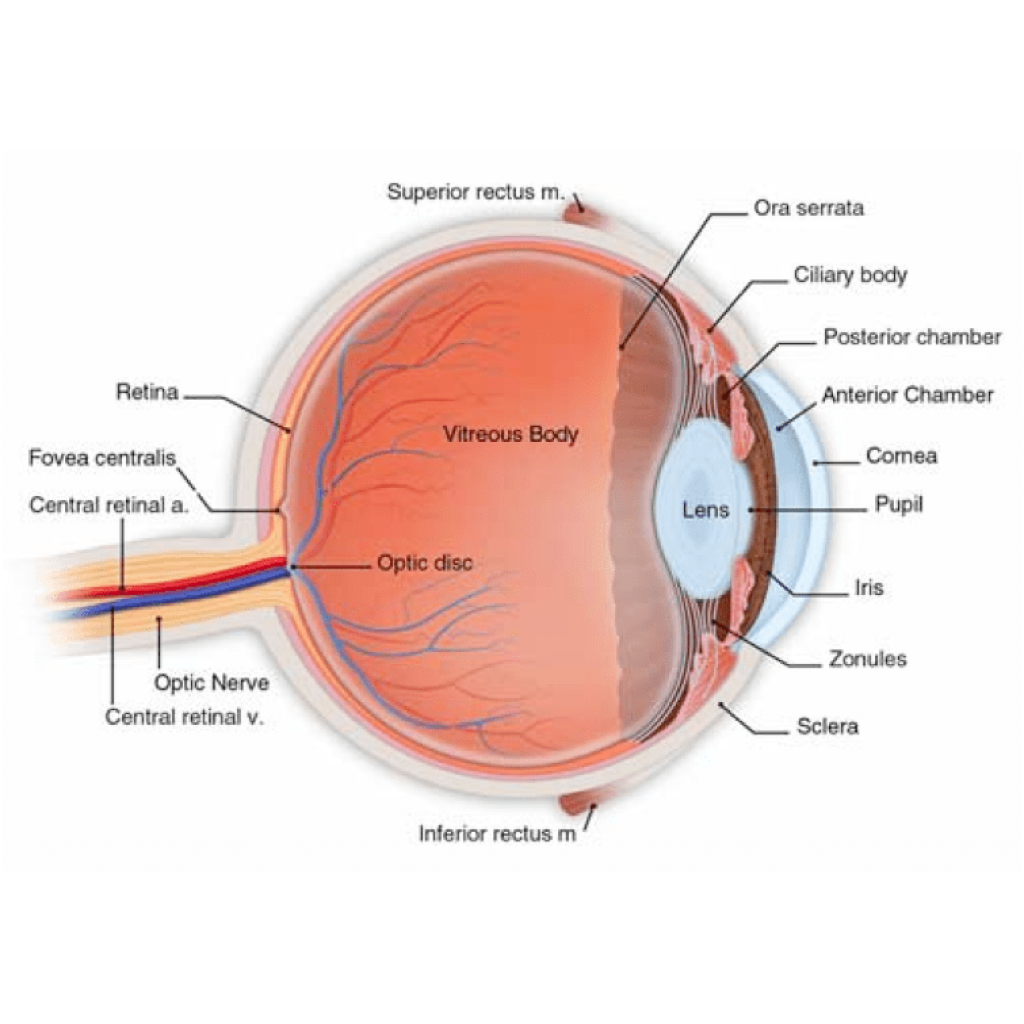
Görme gözden başlayıp, beyinde görme korteksine kadar uzanan olaylar topluluğudur. İnsan gözü üç embriyonik tabakadan meydana gelen farklı dokuları içeren karmaşık bir organdır. Görme yeteneği, ışık ile beynin embriyolojik uzantısı olarak kabul edilen nöral retinanın etkileşimi sonucu oluşan bilginin optik sinir aracılığı ile beyne (görme korteksine) gönderilmesini içeren karmaşık bir durumdur (3, 6). Göz, kompleks ve iyi gelişmiş ışığa duyarlı (fotosensitif) bir organdır. Yaklaşık 24 mm çapında olup, kafatası içinde koruyucu kemik olan orbitalar içine yerleşmiştir. Her göz, küresel şekli koruyan dayanıklı fibröz bir yapıdan, görüntüyü odaklayan bir mercek sisteminden ve görüntüyü toplayan ve merkezi sinir sistemi ileten fotosensitif hücrelerden oluşur. Gözün tabakaları sırası ile ;
-Dış tabaka (tunica fibrosa): sklera ve kornea,
-Orta tabaka (tunica vasculosa): koroid, corpus ciliare, iris,
-İç tabaka (tunica nervosa): retina’dır.
Retina gözün arka tabakasını kaplayan kompleks çok katmanlı bir sinir yapısıdır. Bruch membranı (BM), koroid ve altındaki destekleyici kat olarak sklera ile nöral retina ve retina pigment epitelinden (RPE) oluşur. RPE fotoreseptör hücreleri ile koryokapillaris tabakası arasında yer alan ve birçok açıdan özelleşmiş epitel hücreleridir. Nöral retina, fotoreseptör hücreler dahil olmak üzere birçok farklı hücre tiplerini içerir ve birden çok fonksiyona sahiptir. Işık retina tarafından yansıtıldığında, farklı retinal hücre tipleri nörokimyasal ve optik sinir ile beyine gönderilen elektrik sinyalleri ışığı dönüştürmek üzere birlikte çalışır. Birinci ve bu sistemde en önemli bileşenlerinden biri olan fototransdüksiyon kaskadı, fotoreseptör hücrelerinin ışık duyarlılığını sürdüren bir biyokimyasal sistemidir. Fototransdüksiyon kaskadında rol oynayan proteinler hem RPE de hem de fotoreseptörlerde bulunur. Bu proteinleri şifreleyen genler RPE ve fotoreseptör hücrelerinde yüksek seviyelerde ifade edilir. Retina boyunca gelen ve giden moleküller ve elektrolitlerin hassas bir homeostazı vardır. Kısmen RPE ve fotoreseptörlerde mevcut ifade edilen genler ve proteinler tarafından düzenlenirler. Bu homeostaz örneğin, RPE de ifade edilen genlerden birinde bir mutasyon ya da
fotoreseptörlerde görsel bir fonksiyon üzerinde zararlı etkileri sonucu kolayca bozulur (1, 4, 9).
Şimdi Leber Conjenital Amaurousis hastalığına bakalım .
Leber Conjenital Amaurousis(LCA) hastalığı; retinayı etkileyen genetik bir hastalıktır. Retina ise gözde ışığı ve rengi algılayan özelleşmiş bir yapıdır.

LCA(Leber Conjenital Amaurousis ) ilk defa Theodor Leber tarafından 1869 ve 1871 yıllarında klinik bulgulara dayanarak tanımlandı. Etkilenen yeni doğanlar doğduklarında çoğunlukla körlerdir. LCA genellikle otozomal resesif olarak kalıtılır.
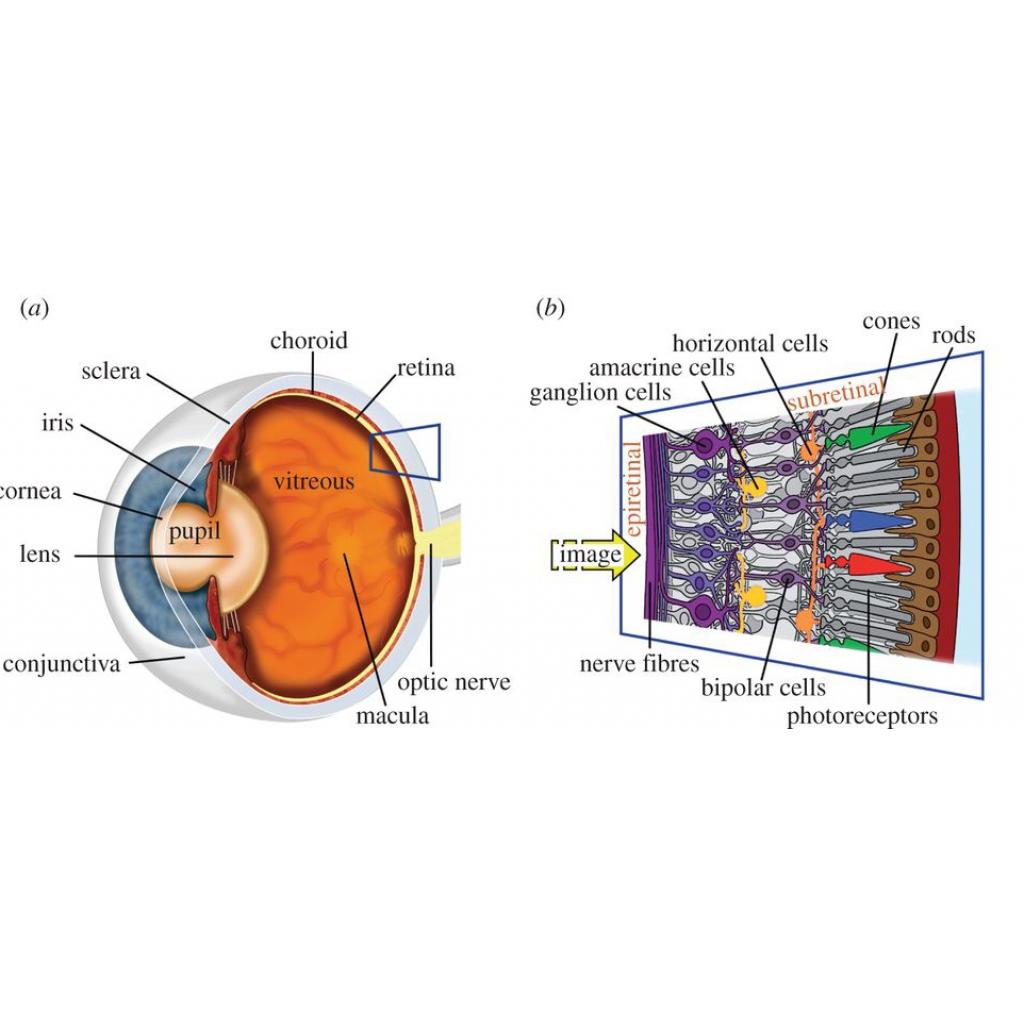
LCA ile doğan çocuklarda retinadaki ışık toplayan hücrelerin(rod ve koniler) işlevi tam olarak gerçekleştirilmez. Bebeklikten itibaren LCA olan insanlarda ağır görme bozukluğu vardır. Bu bozukluk ilerleyici değildir ama çok yavaş bir şekilde zamanla kötüleşebilir.
Doğumda görsel tepkinin azalması hastalığın ilk işaretidir. Retinanın elektriksel aktivitesindeki azalma veya hiç olmaması her zaman gözlemlenen ve LCA teşhisi için gerekli olan bir durumdur.
Ek olarak bu hastalığın diğer belirtileri için;
-Şaşılık,
-İstemsiz hızlı göz hareketleri(nistagmus),
-Işığa anormal hassasiyet(foto-fobi),

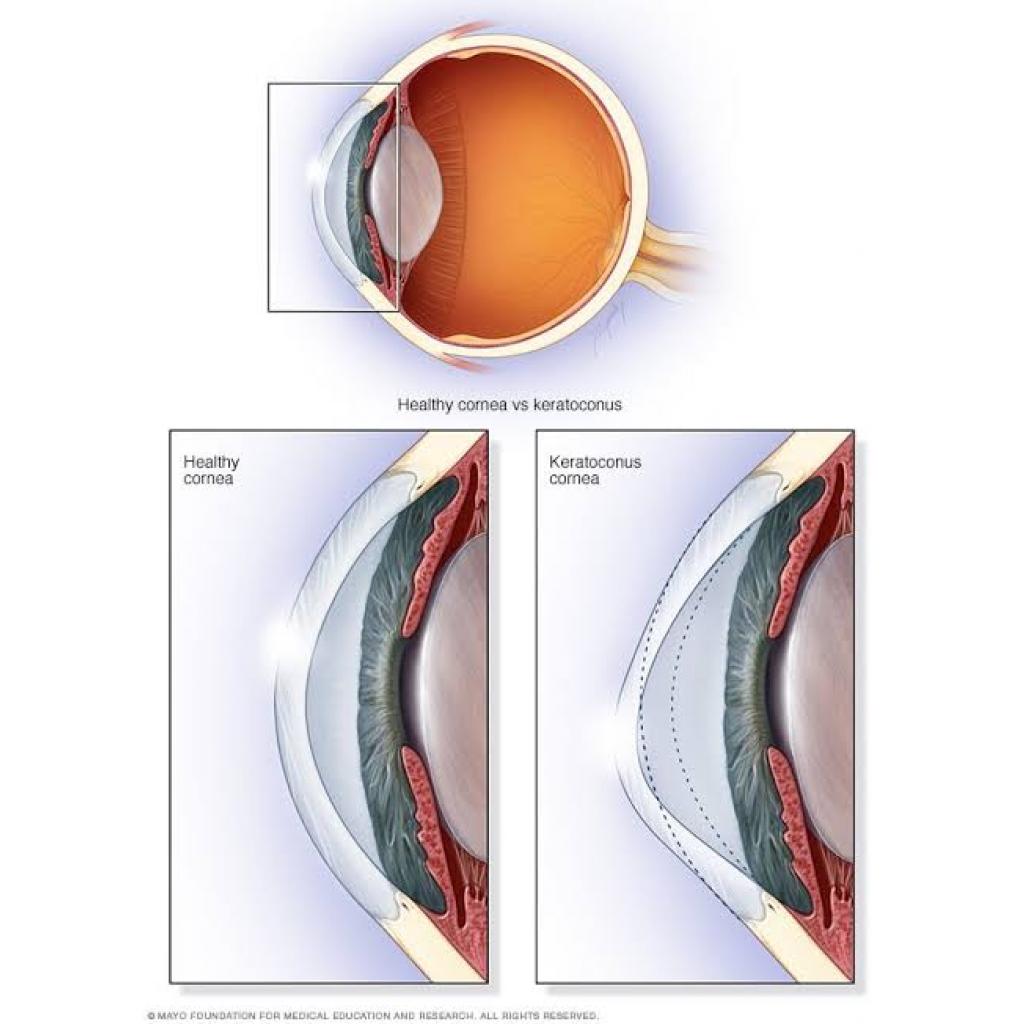
-Katarakt ve gözün ön tarafının koni şeklinde olması(keratokonus) sayılabilir.
Göze giren ışığa bağlı olarak genişleme ve daralmayla bu olayı kontrol eden gözbebeği, LCA olan hastalarda ışığa normal tepki vermez. Görevini normalden daha yavaş bir şekilde yapar ve hatta görevini yapmaz. Ayrıca bazı yeni doğanlarda işitme kaybı, zihinsel gerilik ve gelişimsel gecikme görülebilir.
Özel bir davranış olan Franceschetti’nin okulo dijital belirtisi Leber konjenital amorozisinin karakteristiğidir. Bu hareket gözü itmek, göze bastırmak ve gözü parmağı veya parmak eklem yerleriyle ovalamaktır.
Teşhis Yöntemleri
Genetik veya nadir bir hastalığa tanı koymak çoğu zaman zorlayıcı olabilir. Hekimler hastanın tıbbi geçmişine, semptomlarına, fizik muayenesine ve laboratuar testlerine bakarak teşhis koyabilir. Leber Conjenital Amaurousis hastalığında tanı klinik bulgularla konur.

Elektroretinografi(ERG) retinadaki aktiviteyi ölçerek görsel fonksiyonu değerlendiriyor. ERG bu hastalıkta da kullanılıyor ve Leber Conjenital Amaurousis (LCA) olan bebeklerde retinanın elektriksel aktivitesinin olmadığı ya da azaldığı gözleniyor. Moleküler genetik testler ise LCA ile ilişkili genler için mümkündür. Klinik bulgular, hangi genlerin ve hangi sırayla test edileceklerinin belirlenmesinde yardımcıdır.
Antenatal Teşhis
Doğum öncesinde risk grubunda bulunan yani hastalığa sebep olan mutasyonların belirlendiği çiftler için özelleşmiş laboratuarlar tarafından prenatal teşhis önerilebilir.
Tedavi
Leber konjenital amorozisi için şu anda bir kür bulunmuyor yani kesin tedavisi yok. Tedaviler semptomatik ve destekleyici olarak yapılmakta. Hasta olan çocukların devamlı olarak gözlerini ovmamalarının ve ellerini gözlerine bastırmamalarının da sağlanması gerekiyor. Periyodik olarak göz tembelliği, glokom veya katarakt için oftalmik kontrollerin yapılması da önem arz ediyor. Aynı zamanda bu hastalıktan etkilenen çocukların aileleri için de genetik danışmanlık almaları öneriliyor.
Ancak tüm bunların dışında uygulanmaya başlanan yeni tedavi modeli bulunuyor :
CRISPR, DNA dizilimleri kümesidir. Düzenli aralıklarla bölünmüş palindromik tekrar kümeleri, kısa tekrarı baz dizileri içeren prokaryot DNA segmentleridir. Her tekrarı daha önce maruz kalınan bakteriyofaj veya plazmid kaynaklı kısa “aralayıcı DNA” segmentleri takip etmektedir.
Retinitis pigmentoza, hastalarının büyük kısmında bizzat fotoreseptörlerdeki birçok genin mutasyonun sebep olduğu kalıtsal bir fotoreseptör distrofisidir.
RP nin moleküler temelindeki mevcut bilgiler, nonsendromik RP den sorumlu olan fotoreseptör spesifik genlerdeki mutasyonların tanımlanması ve insanlardakine benzer retinal dejenerasyon geliştiren hayvan modellerinin mevcudiyeti araştırmacıları gen tedavisi çalışmalarına yönlendirmiştir. Çalışmalarda fotoreseptörleri kurtarmak için farklı tip gen tedavisi yaklaşımları kullanılmaktadır. Bunlar 4 ana başlık altında incelenebilir.
1) Fotoreseptör apoptozisini engellemek için kullanılan anti-apoptotik gen tedavisi
2) Birçok farklı tipteki RP modeli için kullanılan nörotropin/growth faktör gen tedavisi
3) Dominant mutant proteinlerin toksik etkilerini bloke etmek için kullanılan ribozom gen tedavisi
4) Eksik genin yerine konulması için kullanılan gen yenileme tedavisidir.
Ancak temel strateji, OR ve X’e bağlı formlarda eksik genin yerine konulması, OD formlarda ise mutant proteinin ekspresyonunu bloke edilmesi şeklindedir.
Son 30 yılda geliştirilen Rekombinant DNA teknolojisi ile iki farklı kaynaktan alınan DNA’ların birleştirilmesi mümkün olmuştur. Burada aktarılması istenen belli bir DNA bölgesi (örneğin insan Rb geni) onu hücreye taşıyacak uygun bir taşıyıcı vektöre (bir DNA virüsü) aktarılır. Bu yolla gen tedavi protokolleri oluşturulmuş ve deneysel bazda uygulama alanı bulmuştur. Burada aktarılmak istenen geni istenilen hücrelere götürmesi gereken en uygun viral vektörün yapılması başarı için en önemli parametredir. Leber’in konjenital amorozisi retinal distrofiler içinde erken dönemde yer alan gruptandır ve görme kaybı, nistagmus, retinal disfonksiyon bulguları ile karakterizedir. Günümüzde bu hastalıkla ilgili 15 farklı gen ortaya konmuştur. Hastalıklarda genetik tanı ve buna bağlı gen tedavileri esastır. Leber’in konjenital amorozis olgularında “in vivo” deneylerde adenoviruslardan oluşturulan gen tedavi yöntemleri başarı ile uygulanmaktadır. Retinal dejenerasyon olgularında da benzer klinik uygulamalarda başarılı sonuçlar alınmaktadır. Bu konuda 2008 yılında üç farklı klinik çalışma yayınlanmıştır. Her üç çalışmada da vektör olarak adenoviruslar kullanılmış ve elde edilen başarılı sonuçlar sunulmuştur. Her üç çalışmada da
vektöre bağlı bir yan etkinin ortaya konmaması bu tür çalışmaların başarısını gösteren önemli parametrelerdir. Çalışma yapılan birçok olguda da görme alanı düzelmiştir. Halen süren çalışmalarda bu sonuçları daha iyiye taşıyacak vektör dizaynları üzerinde durulmaktadır. Gelinen noktada toplumda görülme sıklığı fazla olan hastalıklarda ileri tanı ve tedavi yöntemlerinin geliştirilmesinin yolu moleküler biyoloji ve genetik bilgilerimizin artmasına bağlıdır. Bu yolla elde edilecek bilgiler göz hastalıklarında uygulama alanına girebilecek ileri tanı ve tedavi protokollerinin bulunmasını sağlayacaktır. Bu nedenle özellikle kök hücre tedavisi ve gen tedavisi yöntemleri umut vaat etmektedir.
Bu konuyla ilgili yapılan bir çalışmanın anlatıldığı gerçek bir yaşam öyküsü olan “ Karanlıktan Aydınlığa “ adlı yazıyı okumak için aşağıdaki linke tıklayabilirsiniz .

Kaynakça :
http://www.retinavitreus.com/abstract.php?id=222
https://www.pediatr-neonatol.com/
https://www.pnas.org/content/by/section/Systems%20Biology
https://www.ncbi.nlm.nih.gov/m/pubmed/


