Hücreler “Lav Lambası” Proteinleri ile Ölümü Yenebilir!
Gerçekten karışmayan; ancak belirli şartlar altında, lav lambasında hareket eden damlalar gibi kümelenen ve ayrılan farklı özelliklere sahip sıvıları düşünün. Sıvı-sıvı faz ayrılması olarak da bilinen bu fenomen, bir zamanlar sadece kimyasal bir işlem olarak kabul ediliyordu. Ancak on yıldan daha kısa bir süre önce, Princeton Üniversitesinde biyofizikçi olan Clifford Brangwynne bunun hücrelerde de olduğunu ilk gözlemleyen kişilerden biri oldu ve o zamandan beri biyologlar bu fenomeni öğrenmeye çalışıyorlar.

Kaynak: http://www.dutchglow.org/nostalgia-and-lava-lamps-wisconsin-public-radio-1a313460b28b62da.html
Bilim insanları, evrimin belirli proteinleri aggregat benzeri sıvılar gibi davranması için ayarladığını düşünmeye başladılar. Bu proteinler, faz ayrımı sayesinde kendilerini spontan bir şekilde hücrelerinde gerekli görevleri yerine getirebilecek dinamik, zarsız, damlacık benzeri yapılara dönüştürebiliyorlar.
Dresden, Almanya’da Max Planck Institute of Molecular Cell Biology and Genetics (MPICBG)’de biyolog olan Simon Alberti şöyle dedi; “Her nasılsa, hiç kimse bu tür yetenekleri olan moleküllerin işlevselliklerini sağlamak veya işlevlerini düzenlemek için evrimden faydalanabileceğini düşünmüyordu.”
Max Planck Institute for the Physics of Complex Systems’de biyofizikçi olan Vasily Zaburdaev şöyle dedi; “Bu buluş hücresel organizasyon ve fonksiyon anlayışımız için büyük etkilere sahiptir.”
Son bulgulardan biri faz ayrılmasının, belirli hücrelerin besinlerden mahrum kaldıklarında veya başka türlü strese maruz bırakıldıklarında ölümü atlatmalarını sağlamasıdır. Faz ayrılması, hücrelerin sitoplazmalarının büyük bir bölümünün sıvıdan katıya dönüşmesini sağlar – temelde, besin maddeleri geri dönene kadar hücreler kendilerini sert bir staz durumuna sokarlar.
Membransız Organeller
On dokuzuncu yüzyıl hücre biyologları organel terimini (Latince “küçük organ”) hücrelerin içinde gördükleri minik bileşenleri tanımlamak için oluşturdular. O zaman bile, Amerikalı hücre biyoloğu Edmund Beecher Wilson gibi alandaki öncüler, jöle benzeri sitoplazma dolu hücrelerin “Farklı kimyasal yapıdaki asılı damlalar gibi” çeşitli sıvıları içerebileceğinden şüpheleniyorlardı. Bununla birlikte, bu ilk bakış açısı, neredeyse bir yüzyıl boyunca biyolojide çok az değer gördü: Araştırmacılar, basitçe damlacık şeklindeki herhangi bir hücresel organelin, içeriğinin sitoplazma ile karışmasını önlemek için kapsülleyici bir lipit zara sahip olması gerektiğini varsayıyorlardı.
Buna rağmen; Irvine, University of Calfornia’dan L. Dennis Smith ve National Institute of Environmental Health Sciences’dan Edward Mitchell Eddy, 1960 ve 1970’lerin başlarında bazı organellerin membrana sahip olmadığını elektron mikroskobuyla gösterdiler. Zaman içinde, hücre çekirdeğindeki yoğun bir yapı olan nükleol gibi membransız yapılar bulunmaya devam etmiştir. Yine de 2009’a kadar nasıl ve neden oluştukları belli değildi.
O yıl, Brangwynne MPICBG’de genç bir doktora sonrası öğrencisi iken o, meslektaşı Christian Eckmann ve danışmanı Tony Hyman beklenmeyen bir şey gördüler: Yuvarlak solucan Caenorhabditis elegans’ın hücrelerinin içindeki P granülleri denilen düzensiz ve tutarsız organel dağılımına bakıyorlardı. P granüllerinin, yoğun RNA ve protein topakları olduğu yaygın olarak kabul ediliyordu. Ancak Brangwynne, Eckmann ve Hyman, granüllerin katı bir yapıda olmadığını gördüler. Bunun yerine, iyi çalkalanmış bir sirkedeki yağ gibi daha büyük damlalar oluşturmak için bir araya gelen sıvı damlaları gibi görünüyorlardı.
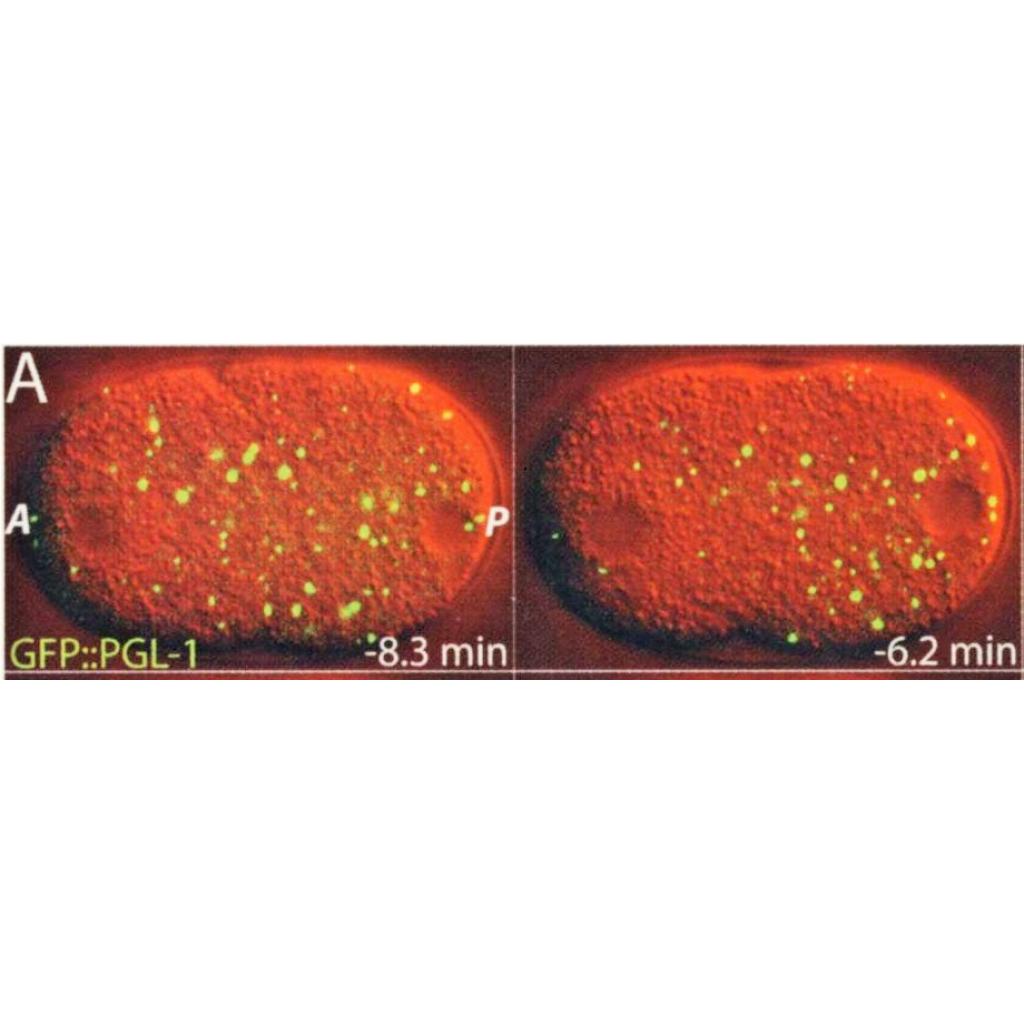
Kaynak: https://science.sciencemag.org/content/324/5935/1729
Brangwynne şöyle dedi; “Bu keşif şans eseri oldu. Sıvı olduklarını keşfettiğimizde, aldığımız birçok kantitatif ölçümler mükemmel bir şekilde mantıklı hale geldi.” Bu keşif ayrıca biyologların hücrelerin nasıl çalıştığı hakkındaki anlayışlarını değiştirdi.
Yapısal biyolog ve Dallas’da yer alan University of Texas Southwestern Medical Center’da biyofizik departmanının başkanı olan Michael Rosen, laboratuvarda damlacıklar halinde birleşebilecek belirli proteinler ve RNA molekülleriyle bu tip bir faz ayrımını üreten ilk kişi oldu.
Bununla birlikte, bazı durumlarda, araştırmacılar sürecin geri dönüşümlü olmadığını – ve bu başarısızlığın nörodejeneratif hastalıklar ve kanser de dahil olmak üzere geniş bir hastalık yelpazesiyle ilişkili proteinlerin bir işlevini temsil ettiğini keşfettiler. Örneğin, Zaburdaev, bazı hastalıklarla ilişkili bir proteinin birkaç mutant formunun anormal faz ayrılma davranışı gösterdiğini gözlemledi. “Düzgün damlalar oluşturmak yerine, çok garip kirpi benzeri yapılar oluşturuyorlar” dedi.
Hayatta Kalmak İçin Katılaşma
Zaburdaev ve Alberti de dahil olmak üzere çalışma arkadaşlarından bazıları, hücrelerde sıcaklığın düşürülmesi ve besinlerin kesilmesi gibi stres durumlarında proteinlere ne olduğunu araştırmaya karar verdiler. Ortaya çıkardıkları şaşırtıcı sonuç, faz ayrılmasının bir hücrenin hayatta kalma mekanizmasının bir parçası olabileceği idi.

Kaynak: https://www.sciencedirect.com/science/article/pii/S0022283618306673
Hücrelerin davranışı ayıların kış uykusuna benzetilebilir. Hayvan haftalarca uykuda kalır ve enerji tüketimini minimuma indirir. Hücresel düzeyde ise faz ayrılması jelatinimsi sitoplazmanın daha katı, koruyucu bir duruma geçiş yapmasına yardımcı olur. Zaburdaev şöyle dedi; “Bu ‘katılaşmış’ durumda, bir hücre açlıktan kurtulabilir.”
Araştırmacılar bu olguyu maya ve amipleri besinden mahrum bırakarak çalıştılar. Besin yoksa enerji yok demektir ve maya hücrelerinin, biyokimyaları için gerekli olan nötr pH değerini korumak amacıyla protonlarını sitoplazmalarından pompalamaları gerekir, bunun için de enerjiye ihtiyaç duyarlar. Zaburdaev, “Hücreler açlıkta asidikleştiler” dedi. Daha asidik koşullar altında, proteinler çözünmüş bir durumdan daha yoğun ve katı olan bir hale dönüştüler ve iyi karışmış sitoplazma, jelatinimsi kabarcık kümelerine ayrıldı.
Bilim insanları, hücrelerin ortamının asitliğini değiştirerek, hücreleri besinsiz bırakmadan bile bu hayatta kalma durumuna geçmelerini sağlayabiliyorlar. Hücreler saatlerce hatta günlerce bu şekilde dinlenebilir. Alberti şöyle diyor; “Hücrelerin şekillerini koruyacak kadar sert olduklarını gördük. Tamamen farklı bir maddesel duruma geçiyorlar.” pH normale döndürüldüğünde hücrenin de normal haline döndüğü gözlemlendi.
Bilim insanları mayayı ozmoz yoluyla tamamen dehidre ederek de faz ayrımı ve katılaşmayı tetikleyebileceklerini buldular. Bununla birlikte, farklı stres tiplerinin (Ozmoz, asidikleştirme), farklı katı halleri indüklediği gözlemlenmiş. Alberti, bunun mekanizmasının “Henüz anlamadığımız bir şey” olduğunu söyledi.
Bu durumun kış uykusu ile karşılaştırılması ise mecazdan fazlası olabilir. Alberti şöyle dedi; “Kış uykusundaki memelilerin hücreleri de katılaşabilir. Bu tür çevresel değişimlerle başa çıkmak için mükemmel bir yol çünkü katılaşma için gereken enerji sıcaklık değişimi veya pH’daki düşüşten çıkıyor. Ancak, faz ayrılmasının söz konusu olduğu hipotezin hala test edilmesi gerekiyor.”
Metabolik Kontrol İçin İmmobilizasyon
Alberti, bir şeyi kapatmanın en iyi yolunun, maddenin tekrar ihtiyaç duyulana kadar geri dönüşümlü bir şekilde hareketsiz hale getirilebileceği katı bir malzemeye konulması olduğunu söyledi. “Bu, molekülleri hasardan korumanın ve aynı zamanda onları kapatmak ve daha sonra kullanmak üzere saklamanın bir yoludur.”
Ekip, bir proteinin belirli bir tanımlanabilir alana veya bölgeye sahip olması durumunda, kolayca geri dönüşümlü jeller oluşturabileceğini buldu. Bu alanın yokluğunda, protein geri dönüşümsüz bir şekilde katılaştığı ve tekrar kullanılamaz hale geldiği gözlemlendi.
Alberti şöyle dedi; “Bu alan, proteinin iyi bir jel türünde birleşmesi ve geri dönüştürülemez bir şey olmaması için yeni bir imkan sunuyor.”
MDI Biological Laboratory’de biyolog olan Dustin Updike şöyle dedi; “Bu sonuçlar, doğanın proteinlerin yapı özelliklerini ayarlamak için etki alanı sekansları tasarladığını göstermektedir. Bu çok faydalıdır çünkü hücrelere ‘ısı şoku, pH veya ozmotik stres gibi ani streslere cevap verme mekanizması’ verir. Hücrelerdeki düzenleyici mekanizmalar genellikle genetik seviyede çalışır; bu da mekanizmaların çekirdeğe ulaşan, gen transkripsiyonunu ve uygun bir enzim üretimini başlatan sinyallere bağlı olduklarını gösterir. Ancak bu olaylar zaman alır. Buna karşılık, faz ayrılmaları çok hızlıdır ve strese neredeyse anında yanıt verebilir.”
Keşfin Önemi
Hücrelerdeki faz ayrılmasının kesin mekanizmasını ve etkilerini anlamak, Zaburdaev’e göre organların korunması ve yaşlanma araştırmalarından uzay yolculuğuna kadar tüm büyük biyolojik zorluklarla ilişkili olabilir.
Son zamanlarda, örneğin, Yale Üniversitesi’nden nörobilimci Pietro De Camilli ve meslektaşları, sinapslarda nörotransmiterlerin kontrollü salınımında faz ayrılmasının olabileceğine dair kanıtlar buldu. Nörotransmiter içeren veziküllerin rutin olarak presinaptik membranın yakınındaki kümelerde ihtiyaç duyulana kadar beklediği görülmüştür. De Camilli’nin ekibi, Sinapsin 1 adı verilen bir iskelet proteininin vezikülleri bu kümelere bağlamak için diğer proteinlerle birlikte sıvı bir fazda yoğunlaştığını gösterdi. Sinapsin fosforile edildiğinde, damlacık hızla dağılır ve veziküller, nörotransmiterleri sinaps içine boşaltmaları için serbest bırakılır.
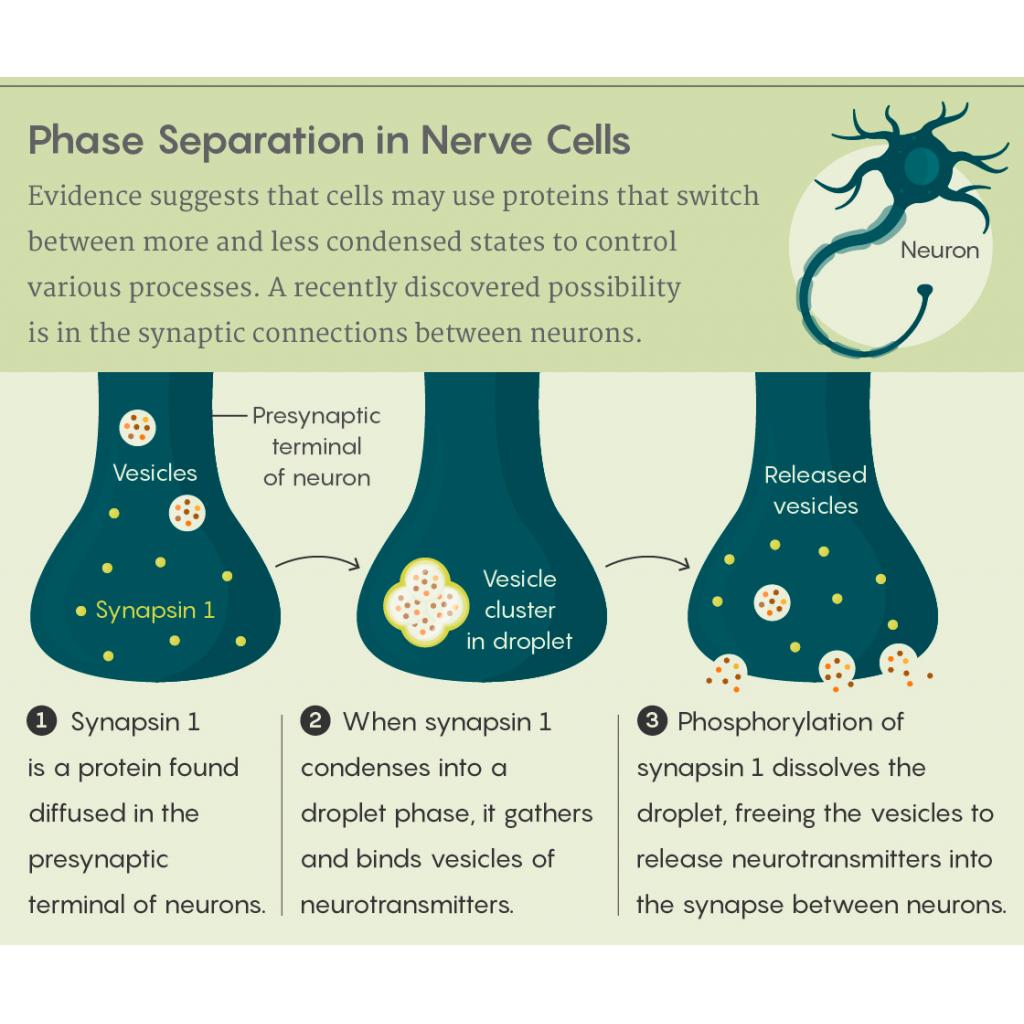
Kaynak: https://www.quantamagazine.org/phase-separating-proteins-may-protect-and-regulate-cells-20181126/
Yine de bu araştırmalar hala erken günlerinde. Brangwynne ve meslektaşları, on yıl önce makalelerini yayınladıklarında, biyologlar bu yepyeni bir araştırma yönü hakkında olumlu ve olumsuz düşüncelere kapıldılar. Updike’nin belirttiği gibi, hücre biyologlarının, protein aggregasyonu fenomeni hakkında düşünmekten, tanımlanması için akışkan dinamiği gerektiren sıvı faz ayrılmasına geçmeleri zor olabilir.
Updike şöyle dedi; “Bana göre, Cliff’in çalışması P granüllerinin doğasını ve gördüklerimizi daha iyi tanımlayan çok büyük bir ilerlemeydi. Bir granülü saflaştırabilirsiniz, ancak daha çok bir yağ damlasına benzeyen bir şeyi saflaştırmak çok daha zor bir iştir.”
Alberti şöyle dedi; “Eleştirilerden biri, bazı insanların her proteinin bunu yapabileceğini söylemeleridir. Bilimde, proteinlerin çeşitli şartlar altında konsantre hale getirilmesinin bazen katılaşmalarına veya sıvılaşmalarına neden olabileceği yaygın bir bilgidir. Fakat bunun aslında hücreler tarafından kullanılabileceği, evrimin bu biyomolekül kabiliyetinden metabolizmayı yavaşlatmak gibi işlevsel bir değişim elde etmek için yararlanabileceği fikri yoktu.”
Brangwynne, bunun biyolojinin geleceği olduğunu söyledi.
Kaynakça ve ileri okuma için;