Glioblastoma Tedavisi Artık Mümkün: Multipl Skleroz (MS) İlacı Kanseri Tedavi Edebilir!
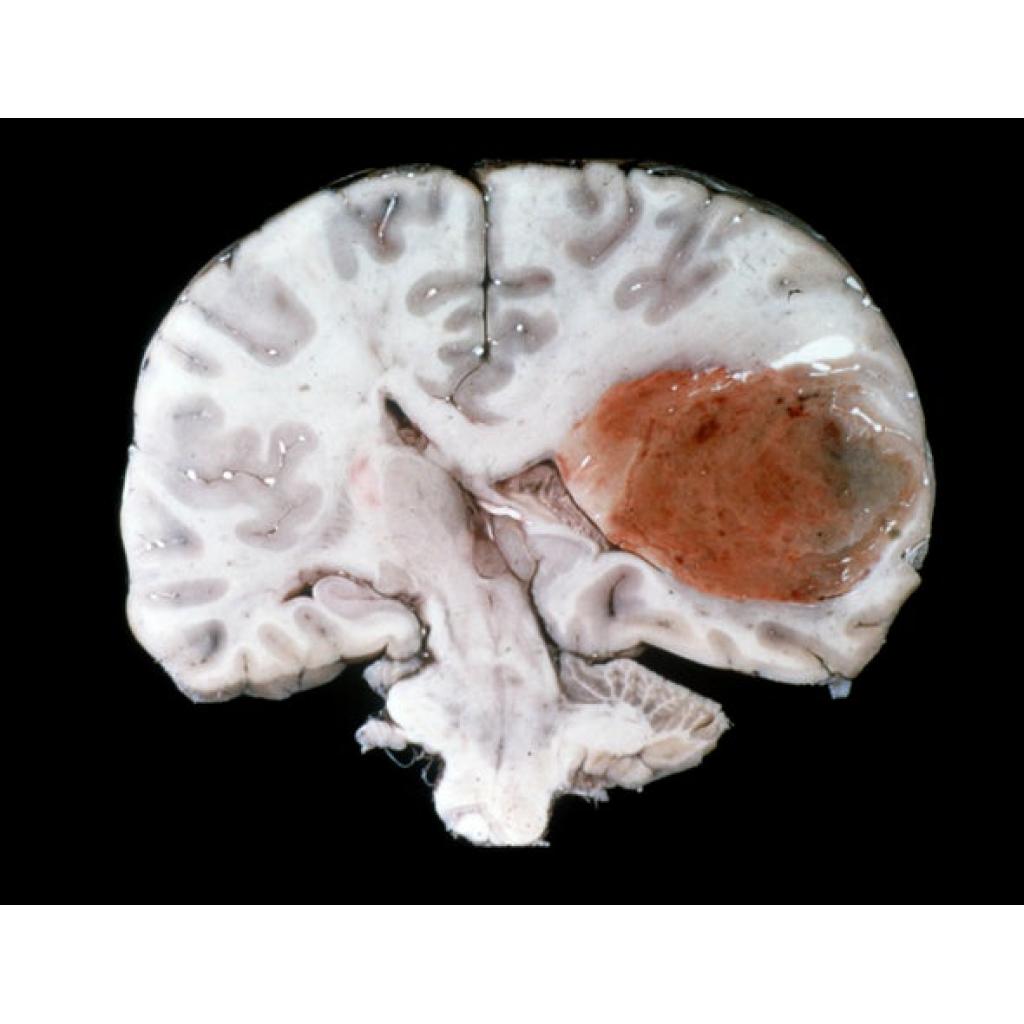
Bir glioblastomdan (bir çeşit beyin kanseri) etkilenen bir beynin kesiti ( koyu, sağ )
Kredi: Getty Images
Glioblastoma Nedir?
Glioblastoma, beyin dokusuna sızan ve ameliyatla tedaviyi zorlaştıran agresif bir beyin kanseri türüdür. Glioblastomlar yetişkinlerde en sık görülen malign beyin tümörleridir. Glioblastoma, sinir hücrelerini destekleyen astrositler adı verilen hücrelerden oluşur. Glioblastoma bazen beynin karşı tarafına bağlantı lifleri (corpus callosum) ile yayılabilir. Glioblastomaların beynin dışına yayılması son derece nadirdir. Yaygın bir şekilde sağlıklı beyin dokusuna yayıldıklarından, cerrahlar nadiren tümörü tamamen çıkarmakta başarılı olurlar. Bu nedenle glioblastomlar ameliyat sonrası radyasyon ve kemoterapiye rağmen çok hızlı bir şekilde nükseder, güncel bilgilere göre tedavi edilemez olarak kabul edilir.
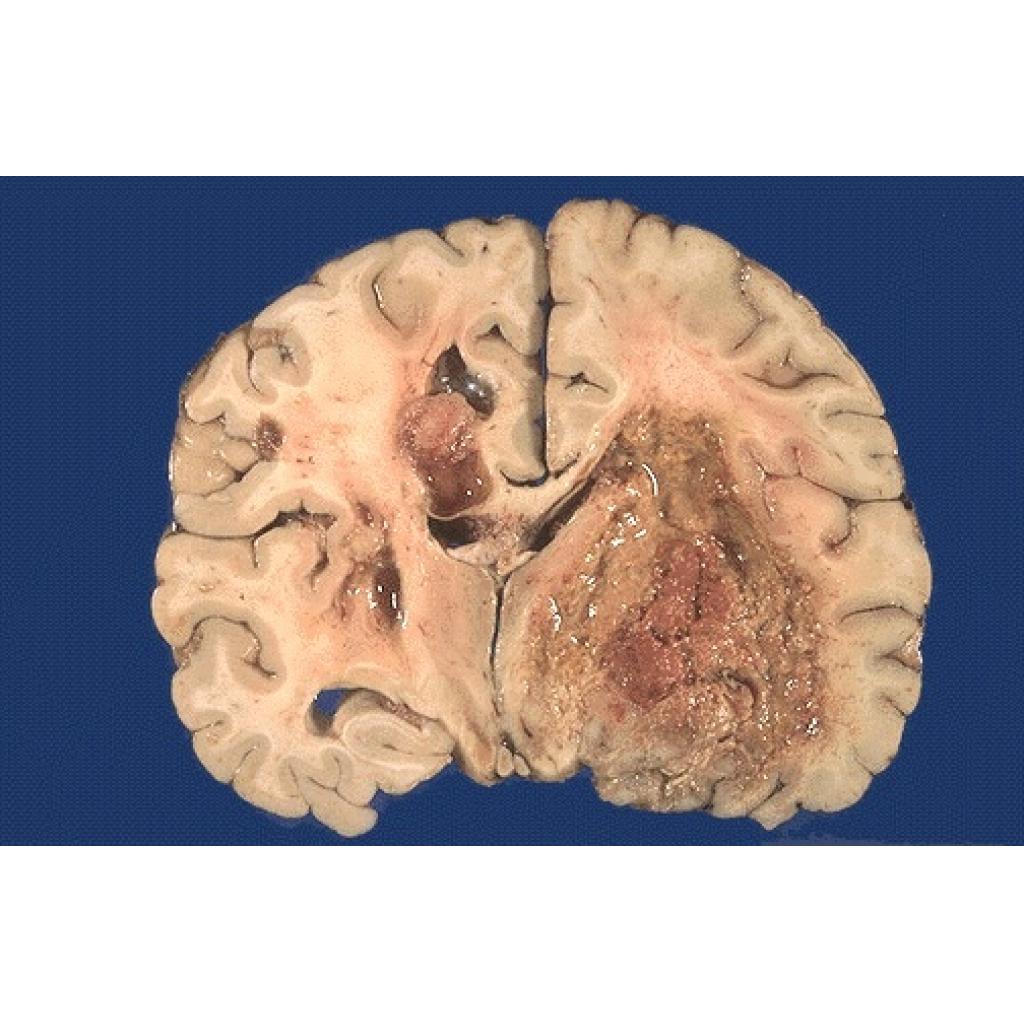
Astrositomlar düşük dereceden yüksek dereceye kadar değişebilir.
Burada görülen bir glioblastoma en yüksek dereceli ve mümkün olan en kötü glioma şeklidir.
Glioblastomalar, belirgin nekroz ve kanama bölgelerinde oldukça vaskülerdir (damarlanmış).
Sağdaki büyük kütlenin orta çizgiyi geçip sol tarafa nasıl sıçrama yaptığına dikkat edin.
KAYNAK: https://webpath.med.utah.edu/CNSHTML/CNS136.html
Bununla birlikte, glioblastomlar hızlı büyümeye başlar ve ilave bir mutasyon, telomeraz üretimini arttırıcı bölgelerden birini kalıcı olarak aktive ettiğinde tümör boyut olarak artar. Telomeraz enzimi; kanser hücrelerinin sınırsız bir şekilde bölünebilmesini ve doğal “limitlerine” erişememelerini, belirli sayıda hücre bölünmesinden sonra ölmelerine neden olur. Sağlıklı hücrelerde telomeraz geni bu nedenle aktif değildir. Üstel büyümeleri sırasında, kanser hücrelerinde sayısız mutasyon birikir.
Glioblastomlar erkeklerde kadınlardan biraz daha yaygındır. Glioblastomlu hastalar, tümörün kendisinden veya tümörü çevreleyen sıvının (ödem) beynin daha fazla şişmesine neden olan kitle etkisinden dolayı hızlı bir şekilde semptomlar geliştirir. Tanıdaki yaygın semptomlar beyindeki artmış basınçla ilgilidir (bulantı, kusma ve sabahları daha kötü olan şiddetli baş ağrıları). Hastalar ayrıca tümörün konumuna bağlı nörolojik semptomlar da gösterebilir. Örneğin; yüz, kol veya bacağın zayıflığı, duyusal değişiklikler, denge güçlükleri ve nörobilişsel hafıza sorunları.
Kanser Kök Hücresi
Kemoterapi ve radyasyon, bir hastanın glioblastom hücrelerinin çoğunu başarılı bir şekilde tahrip ettiğinde bile, kanser kök hücrelerine etki etmeyebilir. Dr Peter Dirks, 2003’te beyin tümörlerinde kanser kök hücrelerinin varlığını keşfeden ilk kişi oldu. Bu tümör kök hücresi popülasyonu süresiz çoğalma kapasitesine sahiptir ve tümörün tekrarlanmasına neden olabilir. Kanser kök hücreleri kemoterapi ve radyasyona karşı dirençlidir. Daha da kötüsü, tedavi sırasında aktive olabilir ve daha sonra tümörün tekrarlamasından sorumludur. Bu özellikle tüm beyin tümörlerinin en saldırganı olan glioblastoma için önemlidir.
“Bir glioblastomun tedavisinden sonra nüksetmesini önlemenin tek yolu, beyin tümörü kök hücrelerini etkili bir şekilde hedef alan bir terapidir. Ancak bu durum kanser kök hücrelerine özgü moleküler hedef yapıları bilmemizi gerektiriyor, böylece tedavi sağlıklı hücrelere zarar vermeyecek . ”
Alman Kanser Araştırma Merkezi’nden Haikun Liu
Bu nedenle Liu ve meslektaşları, beyin tümörü kök hücrelerinin spesifik belirleyici moleküllerini tanımlamayı istediler. Bunun için farelerin glioblastomaları üzerindeki araştırmalarına başladılar. Bilim insanları protein çevirisini ölçmeye olanak sağlayan modern ribozomal RNA dizilim teknikleri kullanarak beyin tümörü kök hücrelerinin protein ekipmanını normal beyin kök hücrelerininkiyle karşılaştırdılar.
Kanser kök hücrelerinde üretilen, ancak beyin kök hücrelerinde üretilmeyen proteinler arasında bir enerji metabolizması enziminin özellikle ilgi çekici olduğunu gördüler.
Gliserol-3-fosfat dehidrogenaz 1 (GPD1) üreten kanser hücreleri bölünmedi ve esas olarak kanserin sağlıklı beyin dokusunu istila ettiği yerler tümörün sınırlarını oluşturdu. Tümör gelişiminin başlamasından yaklaşık iki hafta sonra, araştırmacılar büyüyen tümörde GPD1 üretimini tespit edebildiler.
Gliserol-3-fosfat dehidrogenaz 1 (GPD1)
GPD1’in mayadaki strese duyarlı bir gen olduğu bilinmektedir. Ozmotik stres altında büyüme için gerekli olan gliserol sentezinin temel enzimidir. Ekspresyonu, hücreler stres koşullarına maruz kaldığında uyarılır. Bu gen NAD-bağımlı gliserol-3-fosfat dehidrojenaz ailesinin bir üyesini kodlar. Kodlanan protein, dihidroksiaseton fosfatın (DHAP) ve indirgenmiş nikotin adenin dinükleotitinin (NADH), gliserol-3-fosfata (G3P) ve NAD + ‘ya geri dönüşümlü dönüşümünü katalize ederek karbonhidrat ve lipid metabolizmasında kritik bir rol oynamasına neden olur. Kodlanmış sitozolik protein ve mitokondriyal gliserol-3-fosfat dehidrojenaz ayrıca, indirgen eşdeğerlerinin sitozolden mitokondriye transferini kolaylaştıran bir gliserol fosfat mekiği oluşturur.
Sitozol: Organeller ve suda çözünmeyen zarsız yapılar dışındaki tüm hücre sitoplazmasının sıvı ortamı.
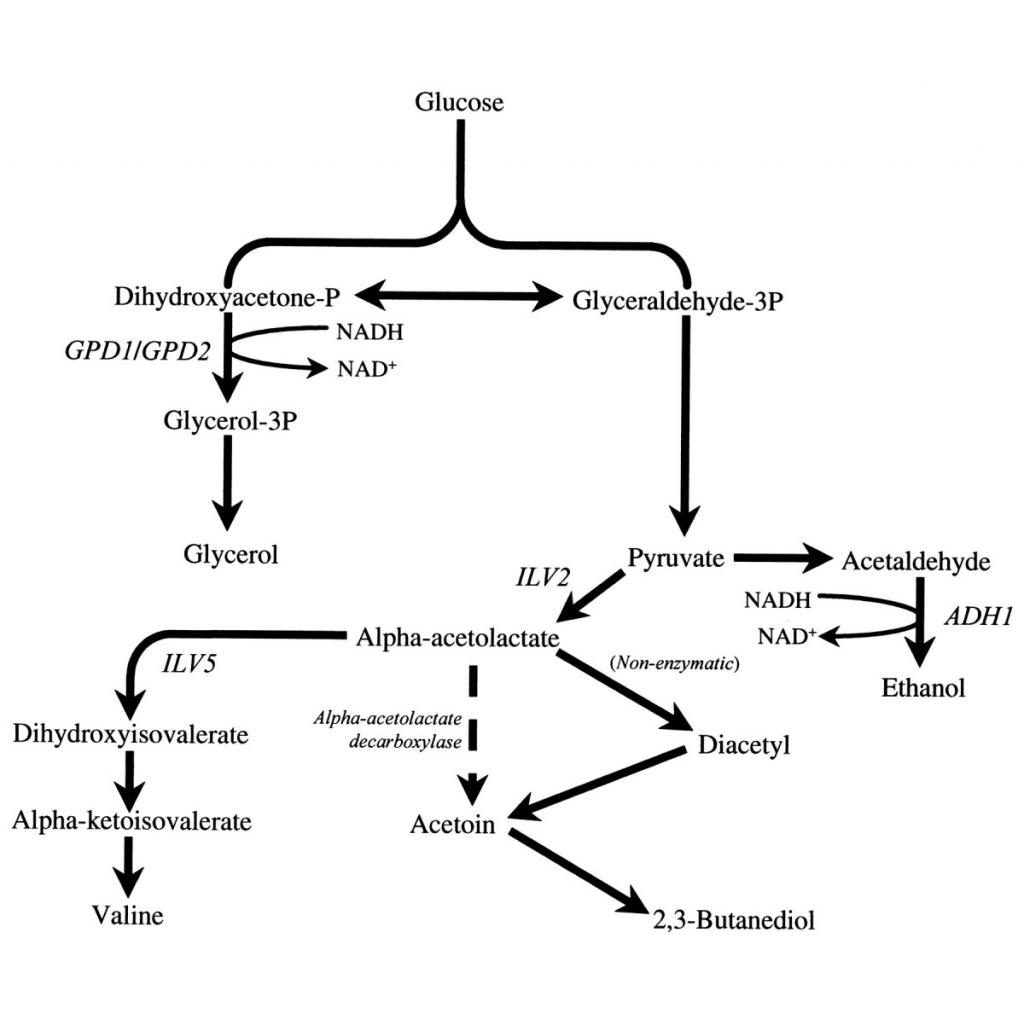
Kaynak:https://mmbr.asm.org/content/64/1/34/F4
Uyuyan kanser kök hücrelerinde GPD1’in spesifik ekspresyonu vardır ancak nöral kök hücrelerde bulunmaz. Kanser kök hücrelerinin stres sinyalleriyle savaşmak için bu enzimi kullandığı bulundu. Ayrıca GPD1 aktivitesine sahip hücrelerin kemoterapiye dirençli olduğu yapılan çalışmalarla ispatlandı.
Araştırmacılar standart kemoterapötik ilaç olan Temozolomid’i farelere uygulamış ve tedavinin sona ermesinden sonra zaman içinde farklı noktalardaki tümörleri analiz etmişlerdir. Tedavi sırasında, GPD1 üreten kanser kök hücreleri uyku hali durumunda kalmamış nüksün başlangıcı ile birlikte, uykularından uyandıklarını gözlemlemişlerdir. Bu GPD1 üreten kanser kök hücrelerin tümörün tekrarlanmasından sorumlu olduklarının güçlü bir göstergesidir. Yüksek GPD1 seviyeleri ayrıca renal hücreli karsinom gibi diğer kanser türlerinde ilerleme ile de ilişkilidir.
GPD1; farelerin tümör kök hücrelerinden CRISPR aracılığıyla genetik olarak elimine edildiğinde, hayvanların daha uzun süre hayatta kaldığını bulmuşlardır.
CRISPR’I AÇIKLADIĞIM YAZI: https://blog.ulubat.org/index.php/makale/bir-arastirma-dosyasi-dunyanin-tasarlanmis-ilk-bebekleri/
Farelerin tümörlerinde olduğu gibi, GPD1 üreten hücreler baskın olarak insan beyinindeki doku bölümlerinde istilacı olarak bulundu . Araştırmacılar GPD-1’i genetik olarak kapattıktan sonra glioblastoma hücreleri, beyin tümörü kök hücrelerinin bir özelliği olan tümör küreleri oluşturma yeteneklerini yitirdiği bulundu.
Tüm sonuçlarımız GPD1’in beyin tümörü kök hücrelerinin istilacılığından sorumlu olduğunu göstermektedir. Normal beyin kök hücrelerinde, enzimin özel bir rol oynadığı görülmemektedir. Fareler GPD1 olmadan sorunsuz yaşayabilir. GPD1 geni mutasyonlardan zarar görmüş kişilerde bile ciddi sağlık sorunları yoktur. Bu, ciddi yan etkileri tetiklemeden enzimi aktif maddelerle bloke etmenin mümkün olduğunun önemli bir göstergesidir . Bu çalışma, uykuda olan beyin tümörü kök hücrelerini karakterize eden protein belirteçlerini belirlemeye ve tümör oluşum mekanizmasındaki rollerini araştırmaya yönelik ilk adımdı . GPD1’in o kadar ilginç özelliklerini keşfettik ki, şimdi enzimi olası yeni tedaviler için bir hedef yapı olarak daha fazla araştıracağız.
Haikun Liu
Cancer Research’de yayımlanan başka bir araştırmanın sonuçlarına göre, araştırmacılar erişkinlerde sık görülen primer beyin kanseri olan glioblastomun büyümesini ve nüksetmesini yavaşlatmak için yeni stratejilerin ortaya çıkabileceğinden ümitliler.
Id-1
Toronto’nun St. Michael’s Hastanesi ve Hasta Çocuklar Hastanesi (SickKids) tarafından yürütülen araştırmalar; Id-1 proteininin tümör oluşumunu başlatması ve büyümesi için kritik olduğunu ayrıca hastalığın kemoterapiye tepkisini etkilediğini öne sürüyor.
Bu çalışmada; bilim insanları Id-1’in kapatıldığı kanser kök hücrelerinin, glioblastomadan korunmasına yardımcı olarak tedaviye daha çok cevap verdiğini buldular.
Araştırmacılar; CRISPR teknolojisi veya geleneksel olarak psikoz tedavisinde kullanılan bir ilaç olan Pimozoid sayesinde laboratuvar modellerinde ve insan hücrelerinde protein Id-1’i “kapattıklarında;” glioblastoma tümörlerinin yavaşladığını buldu.
Id-1 Nedir?
Id1 geninde Id1-001 (veya Id1A) ve Id-1-002 (veya Id1B) olarak adlandırılan 2 transkript vardır. mRNA Id1A, 994 bps, mRNA Id1B ise 1233 bps içermektedir. Id1, helix-loop-helix protein ailesine aittir. 155 aa’dan oluşur. Sarmal ilmek-sarmal konformasyonundan sorumlu olan 143-155 aa’da yer alan bir ana alana sahiptir. Nükleer ihracat sinyallerinden 14 aa tarafından kodlanan ana motifi sorumludur.
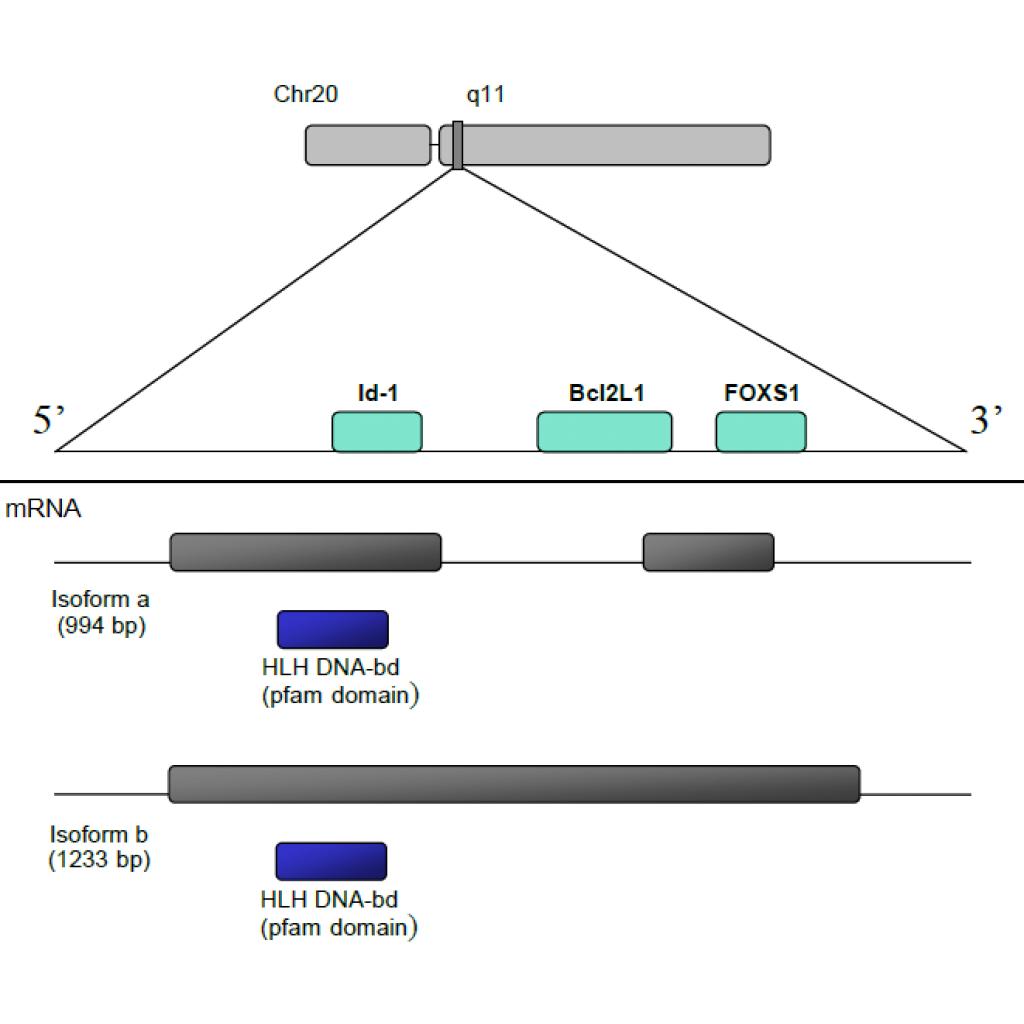
KAYNAK: http://atlasgeneticsoncology.org/Genes/ID1ID40914ch20q11.html
DNA bağlayıcı protein inhibitörü( ID1) beyin, meme ve cilt kanserinde kanser kök hücrelerinin korunmasına yardımcı olarak tümörlerin kemoterapiye dirençli olmasını sağlar. Aynı zamanda fetal hücrelerde ve umbilikal ven endotel hücresinde de eksprese edilir. Id-1; hücre büyümesi, proliferasyon(hücre çoğalması), farklılaşma ve anjiyojenez(damar oluşumu) ile ilgili dokuya özgü genleri kontrol edebilir. Son çalışmalarda glioblastomada, Id-1 perivasküler bölge içinde lokalize beyin kök hücrelerinin bir belirteci olarak tanımlanmıştır. Daha yüksek Id-1 seviyelerine sahip olan bu kök hücreler, tümör başlatma ve tedaviye olan direnç etkisine sahiptir.
Yakın zamanda yapılan çalışmalar Id-1’in, kanser hücresi büyümesini indükleyebildiği ve hücrenin hayatta kalmasını teşvik edebildiğini ortaya çıkardı. Ek olarak, Id-1 proteini 20’den fazla kanser türünde üretildiği bulundu. Bu da çeşitli dokulardaki tümör oluşumunun nedenlerinden birini açıkça gözler önüne serer. Id-1’in tümör ilerlemesine dahil olan çoklu yolları aktive edebilmesi gerçeği, Id-1’in ek olarak tümörün ilerlemesinde de işlev görebileceğini düşündürmektedir. Örneğin, Id-1’in aşırı üretiminin, MT1-MMP proteininin ekspresyonunu indüklediği ve bunun meme kanseri hücrelerinin istilasına yol açtığı bulundu. Hem normal hem de kanser hücrelerinde Id-1 üretimi ile kan damarı oluşumu arasında yakın bir ilişki olduğu da gösterilmiştir Ek olarak, hem nazofarengeal karsinom hem de prostat kanseri hücrelerinde, Id-1 ekspresyonu Raf-1 / MAPK ve JNK yollarını düzenlemesiyle kanser hücrelerini kemoterapötik ilaçtan dolayısıyla apoptozdan(hücre ölümü) koruduğu bulunmuştur.
“Glioblastom için ortalama hayatta kalma oranı iki yıldan azdır. Bulgularımız, tamamen yeni tedaviler oluşturmak için uzun yıllar kaybetmek yerine, kemoterapi gibi sahip olduğumuz tedavilerin etkinliğini artırabileceğimizi ortaya koyuyor.”
Beyin Cerrahı Dr. Sunit Das
Kanser ilacı olan Temozolomid kemoterapisinin sunulması uzun süreli sağkalımı arttırırken, tedavi başarısızlığı ve hızlı tümör tekrarı evrensel kalır. İnsan dokusunda; Id-1’in, glioblastomdaki hücrelerin kemoterapi tedavisine daha dirençli olmasına neden olduğunu araştırmacılar buldu. DNA bağlayıcı protein1’in (Id-1) inhibitörü olan transkripsiyonel düzenleyici protein, kanserde kilit bir düzenleyicidir. CRISPR aracılığıyla Id-1’in glioblastoma hücrelerinde, meme adenokarsinom hücrelerinde ve melanom hücrelerinde devre dışı bırakılmasının, üç kanser sisteminde tümör ilerlemesini dramatik şekilde azalttığını gösterdiler. Ayrıca, Id-1-pozitif hücrelere kemoterapi uygulanmasına rağmen glioblastomda tümör nüksünü durduramadı. Sonuç olarak, bu veriler Id-1’in glioblastomlu hastalarda ümit verici bir tedavi hedefi olabileceğini göstermektedir.Bu bulgular, Id-1’in glioblastoma başlatılması ve kemo dirençli olması için kritik olduğunu ve Id-1 inhibisyonunun Temozolomidin etkisini arttırdığını, tümör tekrarını geciktirdiğini ve hayatta kalma süresini uzattığını göstermektedir.
“Proteini ilaçla hedeflemek glioblastomlu hastalar için yeni ve potansiyel olarak umut verici bir strateji sunabilir. Bir sonraki adımımız; Id-1 için yeni inhibe edici ilaçların geliştirilmesi ve hedeflemenin etkili olmasını sağlamak için bir deneme başlatmak olacaktır.”
Beyin Cerrahı Dr. Sunit Das
Bir diğer yakın zamanda yayımlanan çalışmada California Üniversitesi San Diego Tıp Fakültesi’ndeki araştırmacılar ameliyat geçiren hastalar tarafından bağışlanan glioblastoma tümör örneklerini taşıyan fareler kullandılar . Bu yaklaşımla, multipl skleroz (MS) ilacı Teriflunomid ile yapılan tedavinin glioblastoma kök hücrelerini durdurduğunu, belirgin şekilde tümörleri daralttığını ve farenin sağkalımını iyileştirdiğini keşfetmişlerdir.
MS; bağışıklık sisteminiz, onları korumak için sinir liflerinizi saran miyelin adı verilen yağlı bir maddeye saldırdığında gerçekleşir. Bu dış kabuk olmadan sinirleriniz zarar görür. Skar dokusu oluşabilir. Multipl skleroz; beyninizi , omuriliğinizi ve gözlerinizdeki optik sinirleri etkileyebilecek uzun süreli bir hastalıktır. Görme , denge, kas kontrolü ve diğer temel vücut fonksiyonları ile ilgili sorunlara neden olabilir .
Teriflunomid’in Melanizması Nedir?
Çoğalmaya devam etmek için, glioblastoma kök hücrelerinin daha fazla DNA yapmaya devam etmesi ve bunu yapmak için DNA’nın yapı taşlarından biri olan pirimidin yapması gerekir. MS ilacı Teriflunomid, pirimidin oluşturan enzimleri bloke eder. Rich ve ekibi Teriflunomid’in, glioblastoma hücresinin hayatta kalmasını, kendini yenilemesini ve laboratuarda tümör başlatılmasını engellediğini keşfetti. Araştırmacılar tümörleri sadece Teriflunomid ile tedavi ettiklerinde, tümörlerin hafifçe küçüldüğünü ve onları taşıyan farelerin daha uzun süre hayatta kaldıklarını keşfetti.
Ekip ayrıca iki hedefli kanser terapisini de test etti:
Yalnızca BKM-120 tedavisi ile( bir çeşit tümör inhibitörü), tümörler orta derecede küçülmüş ve fareler, kontrol grubuna(hiçbir tedavi uygulanmamış) veya Teriflunomid ile muamele edilmiş farelere kıyasla daha uzun süre hayatta kalmıştır. Ancak, hem Teriflunomid hem de BKM-120 ile tedavi edildiğinde, tümörler ortalama olarak belirgin bir şekilde küçüldünü ve farelerin, kontrol grubuna veya sadece herhangi bir tedaviyi alan farelere kıyasla daha uzun süre hayatta kaldığını bulmuşlardır.

“Bu sonuçlar konusunda heyecanlıyız, çünkü özellikle insanlarda güvenli olduğu bilinen bir ilaçtan bahsediyoruz. Ama bu laboratuvar modeli mükemmel değil. Evet, insan hasta numuneleri kullanıyor, ancak yine de tümör için önemli bir rol oynadığını bildiğimiz bağışıklık sistemiyle etkileşim gibi insan vücudunda bir glioblastomun sahip olacağı çevreden yoksun. Bu ilaç, glioblastomlu hastalar için uygun hale gelmeden önce, güvenliğini ve etkinliğini desteklemek için insan klinik deneyleri gerekli olacaktır.”
UC San Diego Tıp Fakültesinde profesör ve nöro-onkoloji direktörü ve Beyin Tümörü direktörü Jeremy Rich
Glioblastoma’nın 4 Farklı Hücresel Durumu

Glioblastomun hücresel hallerini temsil eden bir örnek.
KAYNAK: Sébastien Perroud
Hastalığın büyük ölçüde tedavisi zordur çünkü tümörlerin her biri birden fazla tür hücre içerir. Araştırmacılar 20 yetişkin ve sekiz pediatrik glioblastom hastasından 24.000’den fazla tümör hücresinde glioblastoma modellerini analiz etmiştir. Her biri benzersiz bir gen ekspresyon programına sahip dört glioblastoma hücresel durumu buldular. Dört durumun her biri ile ilişkili genetik değişiklikleri belirlediler.
CDK4 , EGFR ve PDGFRA ve NF1 lokusundaki mutasyonların her biri tanımlanmış bir genetik değişikliği temsil eder. Cell’de yayınlanan sonuçlar, hücrelerin oldukça esnek olduğunu, yani dört durum arasında geçiş yapabildiklerini de gösteriyor. Bu şekil değiştirme yeteneği, bu kanser hücrelerinin ilaçlarla öldürmenin neden bu kadar zor olduğunu açıklamaya yardımcı olabildiği gibi glioblastoma için daha iyi tedavileri geliştirmeye de yardımcı olabilir. Glioblastoma tümörlerinin hemen hemen her zaman birden fazla alt tipten oluştuğunu ve bir tümördeki farklı alt tiplerin oranlarının zaman içinde ve tedavi sırasında değişebileceğini çalışmalar göstermiştir.
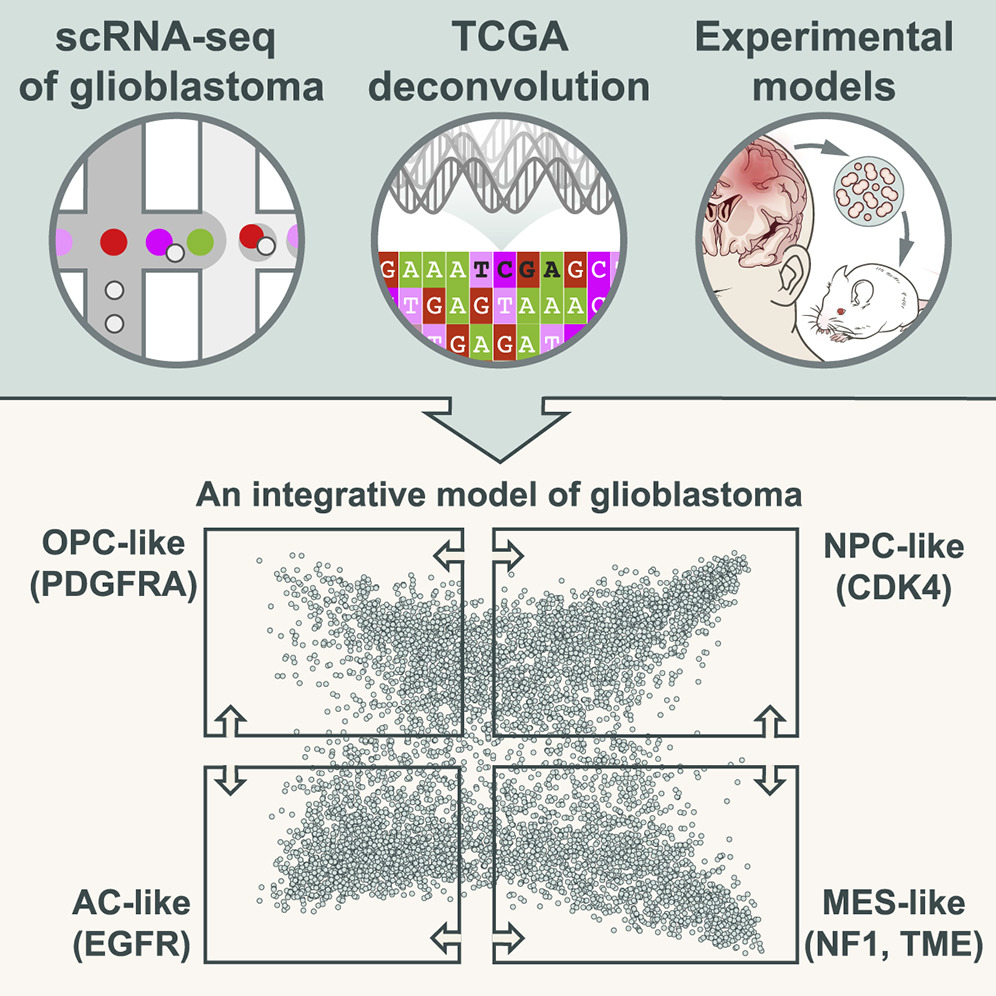
KAYNAK: https://marlin-prod.literatumonline.com/cms/attachment/06fcf901-8b31-4de6-bae2-faea624c7612/fx1.jpg
Bilim insanları hücresel düzeyde glioblastoma durumlarını daha iyi anlamak için tek hücreli RNA dizilimi kullanarak tümörleri incelediler.
“Hücresel durumları ve bunlara bağlı genetik değişiklikleri gelişimsel bağlamda araştırıyor, hangi hücre tiplerinin hastalığı yönlendirdiğini anlıyoruz. Bu çaba bugüne kadar glioblastom için en büyük hücre dizileme çalışması.”
Massachusetts General Hospital Patoloji Anabilim Dalı’nda moleküler bir patolog olan Dr.Mario Suva
Araştırmacılar dört farklı hücresel durum, dört farklı gen ekspresyon programı keşfetti :
- nöral-progenitör benzeri
- oligodendrosit-progenitör benzeri
- astrosit benzeri
- mezenkimal benzeri
Dört durum da normal beyin hücre tiplerine bir dereceye kadar benziyordu ancak hücreleri kanserli yapan önemli farklılıklar vardı.
Dört durum hem erişkin hem de pediatrik tümörlerde araştırıldı ve tümörlerin çoğu her durumda hücrelere sahipken geri kalan azınlığın en az iki durumu temsil eden hücreleri vardı. Bununla birlikte, hücre çeşitlerinin oranları tümörler arasında değişmiş olduğu gözlemlendi. Bu gözlemi test etmek için araştırmacılar, bir insan glioblastoma tümöründen üretilen hücreleri farelere enjekte ettiler, her bir fare sadece bir durumu temsil eden hücreleri aldı. Elde edilen tümörlerin sadece bu hücre durumunu değil, yaklaşık olarak aynı oranlarda bulunan diğer tüm durumları içerdiğini buldular. Bu, glioblastoma hücrelerinin bir durumdan diğer herhangi bir duruma geçebildiğini göstermektedir.
Ekip fare glioblastoma modelinde, insan glioblastoma hücrelerini barındıran farelerin ayrı ayrı hücrelerinin nasıl geliştiğini ve değiştiğini takip etmek için genetik çalışmalar yaptıktan sonra sonuca vardı. Bulgular, mevcut kanser tedavilerinin neden glioblastoma büyümesini durduramadığına dair ipuçları sunmaktadır.
“ Glioblastomanın; her biri farklı bir genetik yapıya sahip birden fazla durumlu bir hastalık olduğunu anladığımızda, her seferinde bir geni hedeflemenin dolayısıyla tedavinin neden başarısız olduğunu daha iyi anlıyıp direnç mekanizmalarını çözebiliyorsunuz.”
Dr.Mario Suva
Sonuç
Glioblastom için acilen yeni tedavilere ihtiyacımız var. Gelecekte tüm glioblastomalar evrimleşebilir. Şu anda, glioblastomu tek bir hastalık olarak düşünme eğilimindeyiz. Ancak o eşsiz biyolojik profillerle alt gruplara sahiptir. Sadece birkaç glioblastoma alt türü olmadığına, muhtemelen yüzlerce olduğuna inanılıyor. Çeşitli biyobelirteçleri ve belirli mutasyonların genetik değişikliklerini incelememiz gerekecek. Tedaviyi özelleştirip hastaya göre düzenlemeliyiz. En çok ilerleyişimiz böyle olacak.
Kaynakça ve İleri Okuma
- https://stm.sciencemag.org/content/11/504/eaau4972 DOI: 10.1126 /scitranslmed.aau4972
- Xiuxing Wang ve ark. Hedefleme pirimidin sentezi, glioblastoma kök hücrelerindeki moleküler terapi yanıtı Science Translational Medicine (2019) DOI: 10.1126 / scitranslmed.aau4972
- http://atlasgeneticsoncology.org/Genes/ID1ID40914ch20q11.html
- https://cancerres.aacrjournals.org/content/79/16/4057 DOI: 10.1158 / 0008-5472.CAN-18-1357
- http://stmichaelshospitalresearch.ca/researchers/sunit-das/
- https://doi.org/10.1016/j.stem.2019.06.004
- https://doi.org/10.1016/j.cell.2019.06.024
DİĞER YAZILARIM
ULUBAT BLOG SON YAYIMLANAN YAZILAR
- Evrim Teorisi ve Bilimsel Bilgiye Giriş
- MİAZMA (MIASMA) TEORİSİ
- BİYOLOJİK CİNSİYET VE TOPLUMSAL CİNSİYET KAVRAMLARININ FARKINI İNSAN FİZYOLOJİSİ VE TARİHSEL SÜREÇ BAĞLAMINDA İNCELEYELİM
- KIRIK KALPLER DURAĞI
- HOUSE MD PİLOT BÖLÜM VAKASI GERÇEK OLDU : TÜRKİYE´DE HİSTOPATOLOJİK OLARAKTANISI KONULMUŞ BİR NÖROSİSTİSERKOZ OLGUSU



