ALERJİLER: SUÇLUSU KİM?
Çoğu insanın sahip olduğu alerjiler, aslında birçok farklı etkenden kaynaklanabilen biyolojik tepkilerdir. Alerji belirtileri kişiler arasında farklılık gösterebildiği gibi, bir kişinin bağışıklık sistemi de her zaman aynı maddeye aynı şekilde karşılık vermeyebilir. Bazılarımız bitkilerden gelen polenlere tepki gösterirken; bazılarımız fıstık, çikolata gibi yiyeceklere tepki gösterebilir. Peki alerjilerdeki bu kişisel farklılıklar neyden kaynaklanmakta ve vücutlarımız ne zaman bir maddeye alerjik şekilde karşılık vermektedir? Bu farklılıklar, kişinin maruz kaldığı alerjinin tipine (örneğin havada uçuşan polenin türüne), konsantrasyonuna ve kişinin daha önce bu etmenle karşılaşıp karşılaşmadığına bağlı olarak gelişebilir.
Alerjilerin Mekanizması
Öncelikle, alerjilerin tam olarak ne olduklarına ve hangi mekanizmalar sayesinde gerçekleştirildiklerine dikkat çekmek istiyorum. Alerjiler genelde zararsız maddelere karşı ‘aslında gereksiz olan’ bağışıklık yanıtları olarak değerlendirilirler (1). Bağışıklık sisteminin bu cevabı, sistemin alerjenleri vücuda zarar verebilecek madde olarak görmesinden kaynaklanmaktadır. Polen, toz, yer fıstığı alerjik tepki gösterilen yaygın maddeler arasında sayılabilir. Son yıllarda gelişmiş ülkelerde alerjilerin daha da yaygınlaşmakta olduğu tespit edilmiştir (1).

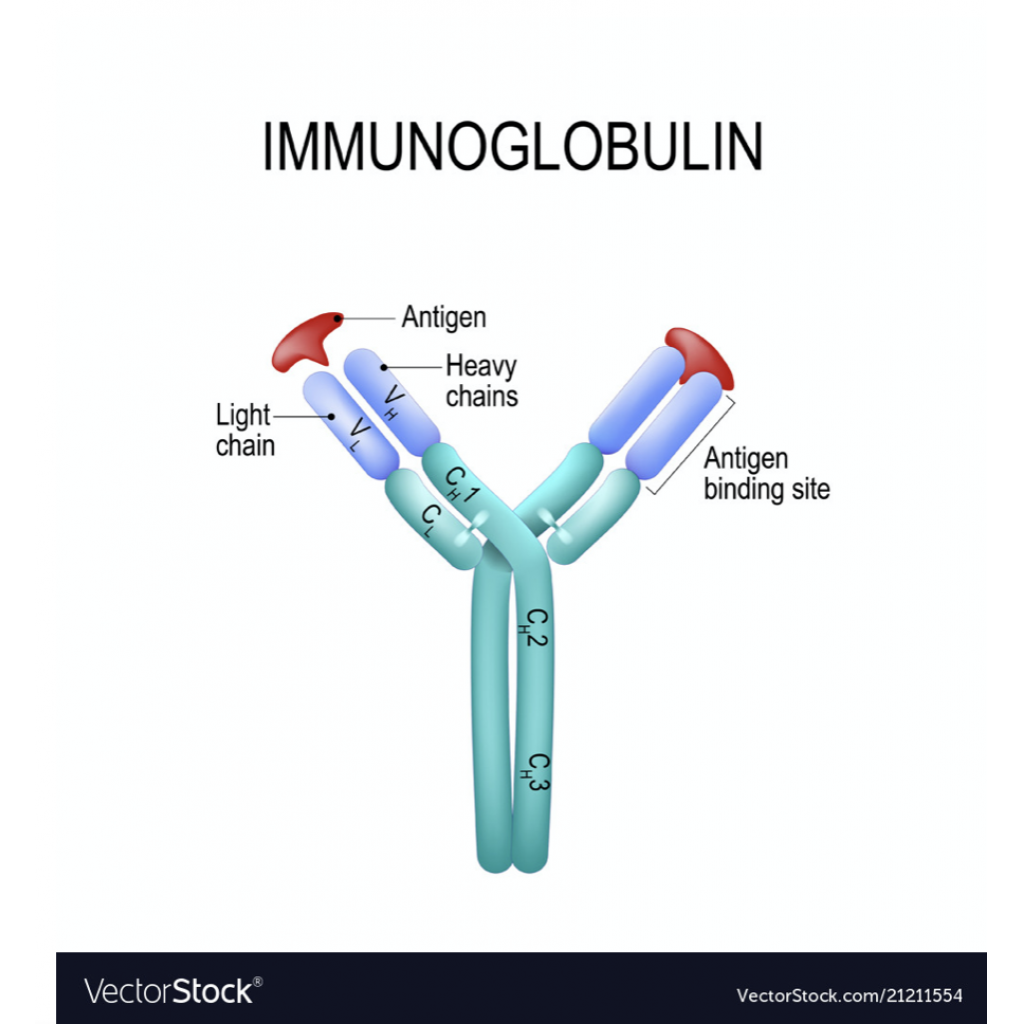
Alerjik cevap, bağışıklık sistemindeki T hücrelerinin bir çeşidinin, yabancı bir hücrenin antijenine teması ile başlar. Bu gruptaki T hücreleri, IL-4 denen bir sitokin molekülünü sentezleyebilmektedir. Lenfositler, antijeni gördükten sonra antikor üretimine başlanması için B hücreleriyle etkileşim kurarlar. Bu etkileşimin sonucunda B hücrelerinden IgE denilen bir antikorun üretimine başlanır. Bu antikorun mast ve bazofil hücrelerine bağlanması sonucunda da bağışıklık sistemi hücreleri, hem alerjeni tanır hem de ona tepki gösterebilecek hale gelmiş olurlar (2). IgE antikoru, diğer antikorlardan farklı olarak 2 tane ağır protein zinciri barındırmakta ve bunun sayesinde de bu antikorlar hedef hücrelerine bağlanabilmektedir (3). IgE antikorunun varlığı ve yönettiği mekanizma, 20. yüzyılda keşfedilmiştir. Prausnitz ve Kustner, yaptıkları araştırmalar sayesinde bir alerjik tepkiye yol açan faktörün hassas bir hastanın serumundan, hassasiyet göstermeyen bir hastanın serumuna aktarılabildiğini gözlemlemişlerdir (3). 1960’lı yıllarda da birbirlerinden bağımsız olarak birkaç grup araştırmacı, IgE’yi bu faktör olarak tanımlamıştır (3).
Bağışıklık mekanizmalarından yola çıkarak, Gell ve ark., alerjik tepkileri 4 farklı kategoride incelemiştir (4). Bu sınıflandırma, zaman içinde değişikliğe uğramış olsa da, bizlere alerjiler ve hipersensitivite tepkileri hakkında bir fıikir verebilir:
Tip 1: IgE antikoruyla birleşen mast hücrelerinin yönettiği, saniyeler içinde histamin gibi etken maddelerin salgılanmasını sağlayan türdür. Bu kategoride astım bronşit, yemek veya bazı ilaç alerjileri ve sistemik anafilaksi gibi durumlar bulunur.
Tip 2: IgE antikorunun hücresel antijene bağlanmasını içerir. Bu etkileşim, antijene sahip olan hücrenin yok edilmesiyle son bulur.
Tip 3: Serbest dolaşan antikorların ve bazı antijenlerin bir araya gelerek oluşturduğu kompleks sayesinde oluşturulan alerjik tepkidir. Histamin ve anafilatoksin salgılanması ile gerçekleşir.
Tip 4: Semptomlar, alerjenle temastan 12-48 saat sonra gerçekleşir.
Bu tip reaksiyonlara ek olarak, yakın zamanda farklı alerjik tepki çeşitleri de önerilmiş ve kabul edilmiştir (3).
Alerjiler Neden Var?
Alerjik tepkilerin mekanizmalarını gördük, ama bu tepkinin oluşmasının altında yatan neden nedir? Dünya’da milyonlarca insan günlük hayatında, özellikle de bahar aylarında, sık sık karşılaştıkları polenler gibi maddelerle temas kurduklarında nefes darlığı, ciltte kaşıntı, hapşırma gibi birçok biçimde tepki verebiliyorlar. Alerjilerin bu kadar yaygın olmalarına ve uzun zamandır bilinmelerine rağmen bilim insanları, hala neden oluştuklarını tam olarak bilmiyorlar (5). Ancak bu konu üzerinde çalışan bilim insanları arasındaki en yaygın düşünce, alerjilerin sadece yanlış yönlendirilmiş birer immün yanıt olduğu yönünde. Yakın zamanda bu düşünceden farklı yönde sonuçlar veren Stanford ve Yale Üniversitesinde yürütülen araştırmalar (6), farelerin bir çeşit zehirle eser miktarda temas kurmalarının vücutta antikor üretimini ve zehirle ilerde karşılaşma olasılığına karşın korunmayı artırdığını ortaya koymuştur. Bu şekilde vücudun zehirlere karşı hazırlık yapabilmesi ve 3 hafta sonra uygulanan ölümcül olabilecek dozdaki zararlı maddeye karşı büyük oranda koruma sağlanmıştır. Kaydedilen verilere göre, ilk başta az miktarda zehire karşı antikor üretebilen farelerin hayatta kalma oranları çok daha yüksek çıkmıştır. Zehirli maddelere karşı, benzer biçimlerde verilen bağışıklık cevaplarının, başka alerjenlere verilen tepkilerin altında yatan mekanizmaları ve nedenlerini de aydınlatabileceği düşünülmektedir (5). Ancak hala, anafilaksi gibi kişinin hayatını tehdit edebilen durumların neden tepki mekanizmalarımız arasında yer aldığı sorusu tam olarak cevaplanamamıştır. Anafilaksi tepkisini, böcek ısırıkları ve yiyecek alerjenler gibi birçok durum tetikleyebilmektedir (7).
Alerjilerin Genetiği
Bilim insanları, alerjiler ne kadar kompleks fenotiplerde kendilerini gösteren hastalıklar olsalar da, genetik bir temelleri olduğu konusunda hemfikirler (8). Aile ağacı ve alerjik hastalıkların sıklığı arasındaki ilişkilerin araştırıldığı çalışmalar; birinci derece aile yakınlarında alerjik hastalık görüldüğü takdirde bireyin alerji riskinde belirgin bir artış olduğunu belirtmiştir (9). Bu artış, ailesinde alerji görülmeyen bir bireyin 3 katı olarak değerlendirilmiştir (8). Dolayısıyla, ailede pozitif vakaların bulunması, alerjik hastalık yaygınlığını ve ilerleyişini anlayabilmek için en önemli araçlardan biri olmuştur. Literatürde, alerjilerin yüksek oranda kalıtsal olduğuna dair birçok bulgu yer almaktadır. Daha güncel çalışmalarda da genom boyu ilişkilendirme çalışmaları (genome-wide association studies, GWAS) sıkça kullanılmış ve birçok yeni bilginin literatüre geçmesine aracı olmuştur. Çalışmalar, hem alerjilerin altında yatan genetik yapılar hakkında fikir oluşturabilmemizi sağlamış, hem de kişinin içinde büyüdüğü ve yaşamakta olduğu ortamların da alerjilerine etkisini daha iyi anlamamız için öncü olabilmiştir.
Yine GWAS modellemelerine dayanarak yürütülen alerjik astım hakkındaki büyük çaplı GABRIEL projesi ve ilerdeki zamanlarda yürütülen buna benzer başka çalışmalarda; bağışıklık yanıtlarını uyaran IL33 ve ST2 gibi lokusların alerjik astımı olan hastalarda belirli mutasyonlara uğradığı ve hastalık ilerleyişinde belirleyici rol oynadıkları kaydedilmiştir (8). IL-33, Th2 bağışıklık cevabını uyarmaktadır ve bu şekilde de alerjik tepkiyi yönlendirdiği düşünülmektedir (10). Dolayısıyla genel olarak alerjilerin genetik temelinde; Th2 hücrelerinin aktivitesini, T hücresi farklılaşmasını, cilt ve mukoza tabakalarının fonksiyonlarını etkileyen genlerin ve lokusların bulunduğu düşünülmektedir (11). Buna ek olarak ilginç bir örnek, kedi alerjisi ile insan lökosit antijenini kodlayan gen arasındaki doğrusal bağlantıdır (12). Ancak hala alerjinin genetik temelleri ve patojenin mekanizmaları hakkında araştırılması ve anlaşılması gereken birçok şey bulunmaktadır.
Alerjilerin artışında etkili olduğu ortaya atılmış bir diğer teori de ‘hijyen hipotezi’dir (13). Bu teori, genel olarak epidemiyolojik araştırmalara dayanmakta ve batı ülkelerindeki aşıların yaygınlaştırılmasıyla enfeksiyon hastalıkların sıklığının oldukça azalmasını otoimmün ve alerjik hastalıkların artışını dile getirmektedir (13). 1989 yılında Strachan tarafından öne sürülen bu teori, ilk olarak bahar nezlesi sıklığının incelenmesiyle ortaya çıkmıştır. Strachan, kendinden daha büyük kardeşleri olan çocuklarda bahar nezlesinin daha nadir görüldüğünü kaydetmiş (14), bu istatistiği de bu çocukların kardeşlerinden dolayı daha az hijyenik ortamlarda bulunma durumunda olduklarına yormuştur (15). Buna dayanarak da erken hayatlarında çeşitli mikroplarla temasta bulunan çocukların, ilerleyen zamanlarda bağışıklık sistemlerinde daha az hipersensitivite durumlarına sahip olacaklarını düşünmüştür. Strachan’ın bu gözlemlerinden sonra birkaç araştırma da laboratuvarda, antikor üretimini takip ederek benzer sonuçları desteklemiştir (15). Ancak yakın zamanda, hijyen hipotezi ve onu destekleyen düşünceler belli değişimlere uğramış, bu hipotezi hem destekleyen hem de reddeden araştırmalar yürütülmüştür. Bilim insanları bu süreç boyunca alerjilerde rol oynayan mikroflora gibi sistemlerin önemini de araştırmaya başlamıştır.
2012 yılında Dünya’daki yetişkinlerin %7,5’inin bahar alerjisiyle baş ettiği tespit edilmiştir (16). Benzer alerjilerin sıklıklarının da artmakta olduğu çeşitli araştırmalarla kaydedilmiştir. Alerjiler de günümüzde yaygın olan birçok hastalık gibi kompleks sağlık durumlarıdır. Yani oluşmalarında ve dışavurumlarında biyolojik ve çevresel birçok faktör etkilidir. Dolayısıyla genetik temellerini tespit etmek ve kesinleştirmek karışık bir süreçtir. Bu konuda sahip olduğumuz bilgi birikimini genişletmek için araştırmalar hala devam etmekte ve her gün alerjilerin mekanizması hakkında bilinenler artmaktadır.
Kaynaklar
(1) British Society for Immunology, Allergy. https://www.immunology.org/policy-and-public-affairs/briefings-and-position-statements/allergy
(2) Janeway, C. ve ark. (2001) Immunobiology: Fifth Edition. New York and London: Garland Science.
(3) Saha G.K. (2016) Mechanism of Allergic Reaction. Dust Allergy: Cause & Concern. Springer, Singapore.
(4) Gell, P.G.H. and Coombs, R.R.A. (1963) The classification of allergic reactions underlying disease. Clinical Aspects of Immunology (Coombs, R.R.A. and Gell, P.G.H., eds) Blackwell Science.
(5) Maron, D. F. (2013) ‘Dear Evolution, Thanks for the Allergies’. Scientific American. https://www.scientificamerican.com/article/dear-evolution-thanks-for/
(6) Palm, N. ve ark. (2013) Bee Venom Phospholipase A2 Induces a Primary Type 2 Response that Is Dependent on the Receptor ST2 and Confers Protective Immunity. Immunity: Volume 39, Issue 5, 14 November 2013, Pages 976-985.
(7) https://www.webmd.com/assetid-091e9c5e80008fc2
(8) Ortiz, R., Barnes, K. (2015) Genetics of Allergic Diseases. Immunol Allergy Clin North Am. 35(1): 19–44. doi:10.1016/j.iac.2014.09.014.
(9) Melen E. ve ark. Genome-wide association study of body mass index in 23 000 individuals with and without asthma. Clin Exp Allergy. 2013; 43:463–474.
(10) Queiroz, G. A., Costa, R. S., Alcantara-Neves, N. M., Nunes de Oliveira Costa, G., Barreto, M. L., Carneiro, V. L., & Figueiredo, C. A. (2017). IL33 and IL1RL1 variants are associated with asthma and atopy in a Brazilian population. International journal of immunogenetics, 44(2), 51–61. https://doi.org/10.1111/iji.12306
(11) Bønnelykke, K. ve ark. (2015) Genetics of allergy and allergic sensitization: common variants, rare mutations. Curr Opin Immunol, October ; 36: 115–126. doi:10.1016/j.coi.2015.08.002.
(12) Hinds, D. A., McMahon, G., Kiefer, A. K., Do, C. B., Eriksson, N., Evans, D. M., St Pourcain, B., Ring, S. M., Mountain, J. L., Francke, U., Davey-Smith, G., Timpson, N. J., & Tung, J. Y. (2013). A genome-wide association meta-analysis of self-reported allergy identifies shared and allergy-specific susceptibility loci. Nature genetics, 45(8), 907–911. https://doi.org/10.1038/ng.2686
(13) Okada, H., Kuhn, C., Feillet, H., & Bach, J. F. (2010). The ‘hygiene hypothesis’ for autoimmune and allergic diseases: an update. Clinical and experimental immunology, 160(1), 1–9. https://doi.org/10.1111/j.1365-2249.2010.04139.x
(14) Strachan, D. P. (1989) Hay fever, hygiene, and household size. BMJ, Nov 18; 299(6710):1259-60.
(15) Stiemsma, L. T., Reynolds, L. A., Turvey, S. E., & Finlay, B. B. (2015). The hygiene hypothesis: current perspectives and future therapies. ImmunoTargets and therapy, 4, 143–157. https://doi.org/10.2147/ITT.S61528
(16) American Academy of Allergy, Asthma and Immunology, Allergy Statistics. https://www.aaaai.org/about-aaaai/newsroom/allergy-statistics