BİR ARAŞTIRMA DOSYASI: DÜNYANIN TASARLANMIŞ İLK BEBEKLERİ
1950’lerin başında, Rosalind Franklin, Francis Crick ve James Watson, DNA’nın kimyasal yapısını keşfettiklerinde; bu insan genlerinin kimyasal modifikasyonu yoluyla iyileştirilebilmesinin de bir başlangıcıydı. Bu keşif genetik biliminin en büyük sıçramalarından biriydi. Watson ve Crick, genetik kökenli hastalıkların tedavisi için çabalayan bilim insanlarının önünü açarak tıp dünyasında da yeni bir kapı aralanmasına yardım etti. Bu aynı zamanda güne yeni umutlarla açılan gözler için de hastalıkların tedavisinin bulunması demekti. Her gün artan yeni edindiğimiz bilgiler, bilim insanlarını şaşkınlıkla birlikte daha fazla meraka ve daha fazla araştırmaya sürüklüyor. Bilim insanları araştırmaya devam ettikçe bilim öyle bir noktaya geldi ki bir yerde insanların gözünde umut oluyorken bir yerde silah, savaş ve gözyaşı oluyor. Bilim işte bu. Bazen belli belirsiz bazen sert ve düzgün çizilmiş bir garip çizgi…
Bu yazıda, işte bu merak ve bir araştırma ürünü olan dünyanın tasarlanmış ilk bebekleri nasıl oldu daha da önemlisi neden üretildi ve bu bebeklerin oluşması için kullanılan CRISPR-CAS9 tekniği nedir gibi sorularının cevabı var. Genetiğin ve bu canlılar üzerindeki deneylerin aydınlattığı yolun sonu insanlık için tehlikeli mi? Bizi ne gibi tehlikeler bekliyor? Her şey pamuk ipliğine mi bağlı? Biyoetik neden önemli? Tüm bunları birlikte irdeleyeceğiz.
CRISPR-CAS9 NEDİR?
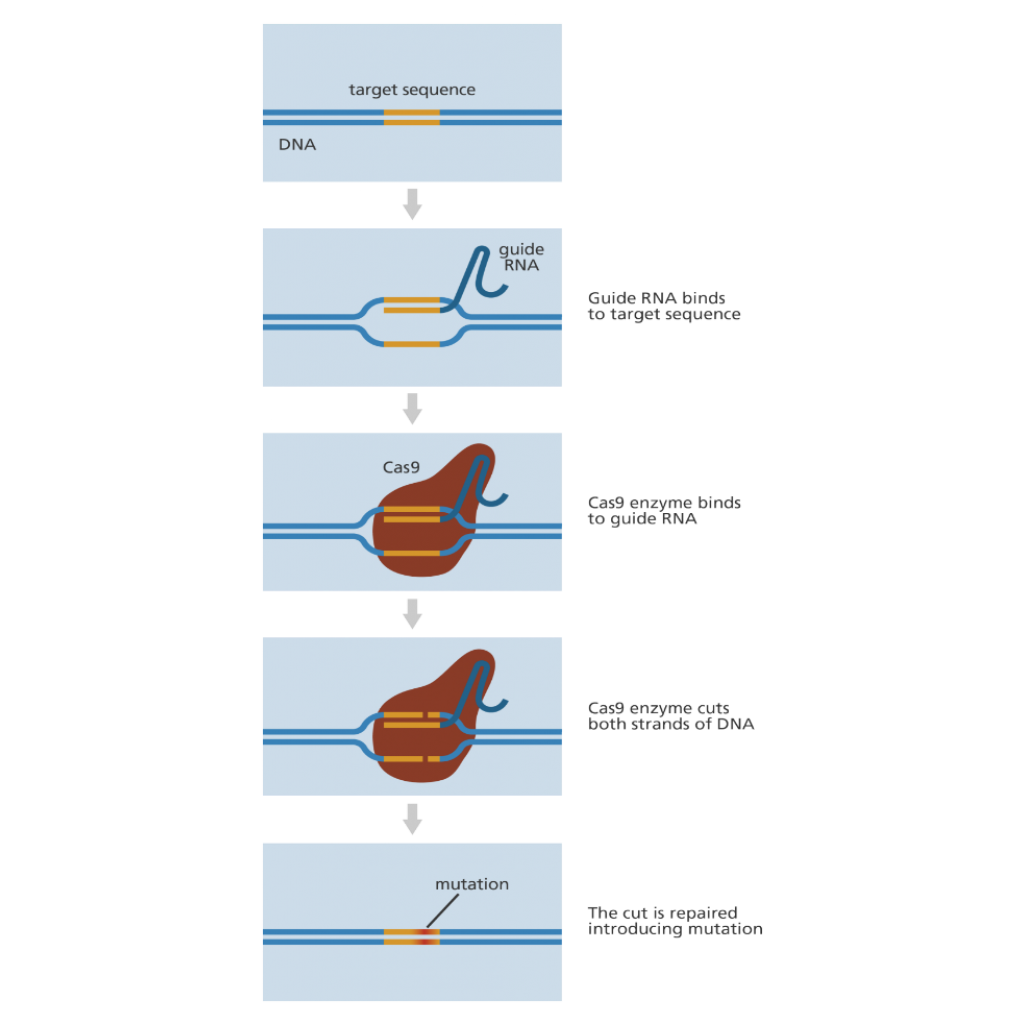
CRISPR / Cas9 terimi, Kümelenmiş Düzenli Olarak Geçişli Kısa Palindromik Tekrarlar / CRISPR ile ilişkili protein 9 anlamına gelir. CRISPR-Cas9 bilim insanlarının, genomun* çeşitli kısımlarına ekleme, çıkarma ya da DNA dizilimininde değişim yapmalarına olanak tanıyan özgün bir teknolojidir. Daha önceki tekniklerden daha hızlı, daha ucuz ve daha yüksek doğrulukta olup, geniş bir uygulama yelpazesine sahip olması bilim dünyasında heyecan yaratır.
*Genom: Bir hücrede veya bir organizmada bulunan bütün genler veya genetik materyal seti
CRISPR-CAS9 MEKANİZMASI NEDİR?
CRISPR-Cas9 sistemi, DNA’da değişiklik (mutasyon) yaratan iki önemli molekülden oluşur:
1. Cas9 adlı bir enzim: Genomun belirli yerlerinden iki DNA iplikçiğini kesebilen “moleküler bir makas” görevi görür. Böylece DNA parçaları eklenebilir veya çıkarılabilir.
2. Rehber RNA (İng. guide RNA – gRNA) denilen bir RNA parçası: Daha uzun bir RNA iskeletin içindeki, önceden tasarlanmış küçük (yaklaşık 20 bazlık) bir RNA diziliminden oluşur. 20 bazlık dizilim CRISPR’ın bilim insanları tarafından kolay düzenlenmesini ve ucuz olmasını sağlar. Rehber RNA, genomdaki hedef DNA diziliminin bütünleyici RNA bazlarına sahiptir. Uzun RNA iskeleti DNA’daki hedef dizilimi bulup bağlanır ve önceden tasarlanmış küçük RNA dizilimi Cas9’un genomun doğru noktasına gitmesine rehberlik eder. Böylece Cas9 enzimi doğru yerleri keser. Rehber RNA’nın, tam olarak eşleştiği bölümü bulmak için çok miktarda genetik materyali taraması gerçekten mümkündür. Cas 9 kesim yaptıktan sonra hücre, DNA hasar gördüğünü fark eder ve onarmaya çalışır. Bilim insanları da işte bu yenilenme sürecinde DNA’yı istedikleri düzenlemeyi yapmak için ikna ediyorlar.
Bilimciler DNA onarım mekanizmasını kullanarak, ilgilendikleri hücrenin bir ya da birden fazla geninde değişiklik yapabilirler.
NASIL BULUNDU?
Emmanuelle Charpentier, George Church ve Jennifer Doudna CRISPR ile çalışan ve bulunmasında önemli katkılar sağlayan bilim insanlarıdır. Bakterilerin bazılarının bünyelerinde CRISPR-Cas9 sistemine benzer bir gen düzenleme sistemi bulunur. Bakteriler bu sistemi işgalci patojenlere, örneğin virüslere karşı yanıt olarak kullanır; yani bir bağışıklık sistemi gibi. CRISPR kullanarak, bakteriler virüs DNA’sından parçalar çıkarırlar ve bir daha saldıracak olursa virüsü tanımalarına ve savunmaya geçmelerine yardımcı olması için birazını saklarlar. Bugün, bu moleküler makineyi tamamen farklı bir amaç için uyarladık:
“Bir organizmanın DNA kodunda seçilen harfleri değiştirmek”
CRISPR-CAS9 VE ETİK
CRISPR-Cas9 genetik temeli olan çok sayıda tıbbi hastalığın (kanser, hepatit B, talesemi, lösemi, orak hücreli anemi ve hatta yüksek kolesterol) tedavisinde kullanılmak için bir umut vaat ediyor. Hatta yeni yayımlanan çalışmalar genetik temelli hastalıkların tedavisinin mümkün olduğunu kanıtlar nitelikte. Önerilen uygulamaların çoğu somatik (bedensel) hücrelerin genomlarının düzenlenmesi ile ilgili olsa da, üreme hücrelerinin düzenlenme potansiyeline ilişkin ilgi ve etik tartışması sürüyor. Çünkü üreme hücreleri üzerinde yapılacak değişiklikler nesilden nesile kalıtımsal olarak aktarılacağı için olayın ahlaki bir boyutu var.Üreme hücreleri üzerinde gen düzenleme yapmak, şu anda Birleşik Krallık da dahil dünyanın pek çok ülkesinde yasa dışıdır.
CRISPR-CAS9 RİSKLİ Mİ?
Örneğin; 20 bütünleyici bazdan 19 tanesi genomda bambaşka bir yerde daha bulunuyor olabilir. Dolayısıyla rehber RNA’nın hedeflenmek istenen yere değil de, başka yere bağlanma riski doğar. Cas9 enzimi de o zaman yanlış yeri keser ve olmaması gereken bir yerde mutasyona* neden olunur. Bu bazen birey için zararsız olur; bazen ise son derece tehlikeli bir durum oluşturabilir.
Mutasyon:Bir organizmanın DNA’sındaki bir gene meydana gelen bazı değişiklikler.
Bilimciler CRISPR-Cas9 sisteminin hatasız bağlanma ve kesmesini garantileyecek iki yol üzerinde çalışıyor:
- Genomun DNA dizilimi ve Cas9-gRNA kompleksinin farklı versiyonlarının “hedef dışı” davranışları hakkındaki bilgi kullanılarak, daha ayrıntılı rehber RNA’lar yapmak.
- DNA’nın iki ipliğini birden değil de, sadece tek ipliğini kesecek Cas9 enzimi kullanmak. Bu da aynı anda iki rehber RNA ve iki Cas9 enzimi kullanmak ve böylece yanlış yerde kesim yapılma olasılığını düşürmek anlamına geliyor.
DNA’mıza geçen, hastalığa neden olan bir hatayı düzeltmek isteyebiliriz. Veya bazı durumlarda bitkilerin, hayvanların ve hatta insanların genetik kodlarını geliştirmek isteyebiliriz .
Tek ihtiyacımız olan dev bir mikroskop ve küçük bir makas. Ve temelde kullanılan şey bu.
Öyleyse sadece istenmeyen bir geni koparır ve yerine iyi bir gen koyabilir miyiz?
Genetik hastalığa neden olan nokta mutasyonu tedavisi için, DNA’daki o mutasyonlu yeri kesmek hasta için hiçbir fayda sağlamaz.Çünkü mutasyonlu genin fonksiyonu yeniden yüklenmelidir. CRISPR-CAS9’la birlikte hücreye verilen sağlıklı gen, mutasyonlu hücrede bulunan DNA onarım mekanizmasını kullanarak yerleşir ve hücrenin normal fonksiyona sahip olmasını sağlar.
Yakın zamanda yayımlanan makaleye göre, süreçte yer alan olayların sırasını daha iyi anlamak için araştırmacılar Cas9 enzimini görüntüleyen cryo-EM teknolojisini buldular.
“Cas9’un DNA iplikçiklerini kesmek ve düzenlemek için gerçekten nasıl çalıştığını çok yüksek düzeyde görebilmek heyecan verici. Bu görüntüler, gen-kurgu sürecinin verimliliğini artırmak için bize paha biçilemez bilgi sağlıyor. Böylece gelecekte hastalığa neden olan DNA mutasyonlarını daha hızlı ve hassas bir şekilde düzeltebiliriz.”
British Columbia Üniversitesi ve Frederick Ulusal Kanser Araştırma Laboratuvarı araştırmacısı Dr. Sriram Subramaniam
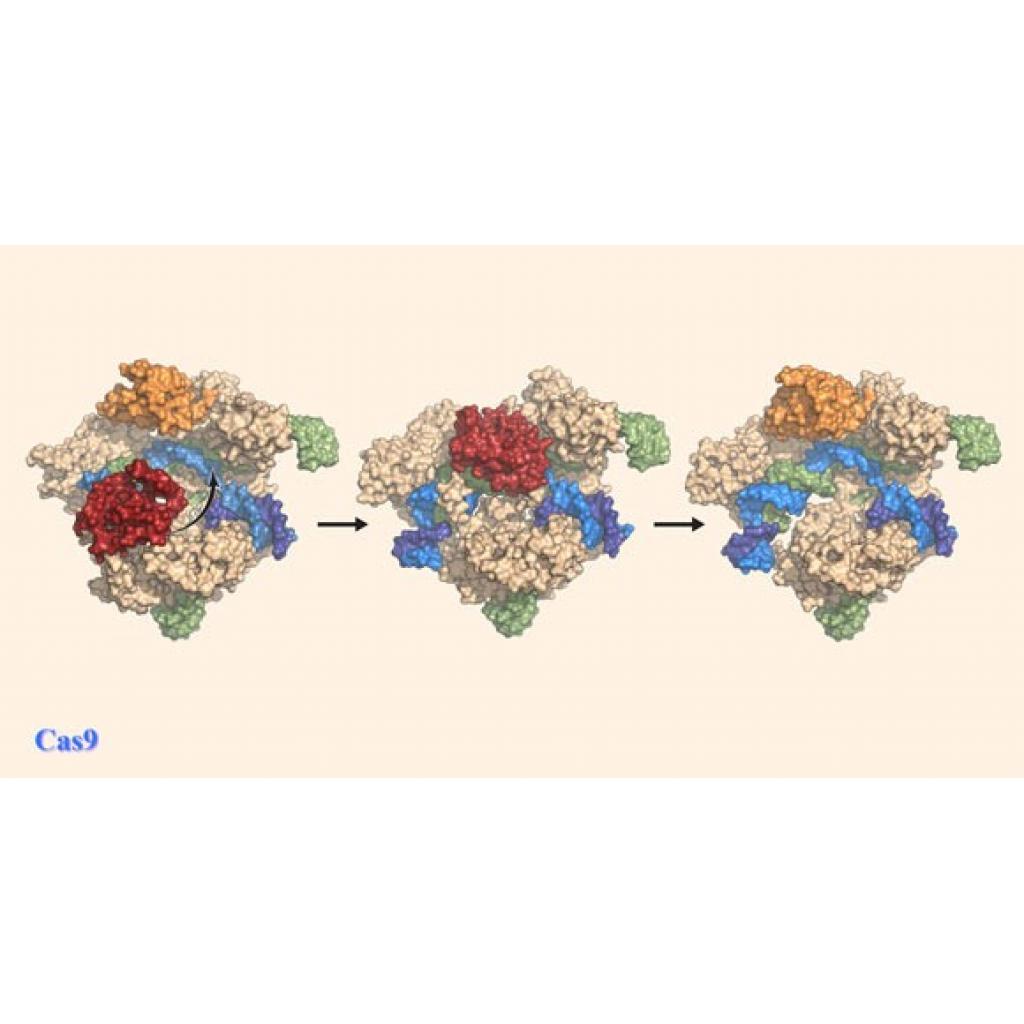
https://www.nature.com/articles/s41594-019-0258-2
“Cas9 kullanarak daha iyi gen düzenleme araçlarının geliştirilmesini önleyen en büyük engellerden biri, DNA’yı kesen hiçbir görüntüye sahip olmadığımızdır.Fakat şimdi daha net bir resme sahibiz ve enzimin ana alanlarının reaksiyon sırasında nasıl hareket ettiğini ve bunun da gen modifikasyonu için önemli bir hedef olabileceğini bile görüyoruz.”
Chicago’daki Illinois Üniversitesi’nden Dr. Miljan Simonoviç
DÜNYADAKİ GENETİĞİ DEĞİŞTİRİLMİŞ İLK BEBEKLER
28 Kasım 2018’de, He Jiankui , Hong Kong’daki İkinci Uluslararası İnsan Genomu Düzenleme Zirvesi’nde Çin’de doğmuş olan Lulu ve Nana’nın, iki ikiz kızının genomunu düzenlediğini açıkladı. Bu, CRISPR-CAS9 tekniği kullanarak modifiye edilmiş DNA ile dünyaya gelen, bildirilen ilk insan vakasıdır.

Çinli bilim adamı He Jiankui, 28 Kasım 2018 tarihinde Hong Kong’da bir insan genom düzenleme zirvesinde deneyi duyurdu.
Anthony Wallace / AFP / Getty Images
HE JİANKUİ KİMDİR?
He Jiankui, ABD’deki Rice ve Stanford üniversitelerinde okudu, Çin’deki Shenzhen’deki Güney Bilim ve Teknoloji Üniversitesi’nde bir laboratuvar açmak için anavatanına döndü. Ayrıca iki genetik şirketi var. Sözcüsü, 2018 yılının başından beri öğretmenlikten izin aldığını, ancak fakültede kaldığını ve okulda bir laboratuvarı olduğunu doğruladı. Çinli araştırmacı, laboratuarda fareler, maymun ve insan embriyolarının düzenlenmesi için birkaç yıl çalıştığını ve metotları için patent başvurusunda bulunduğunu söyledi.
Çin’e döndükten sonra bu projede birlikte çalıştığı ABD’li bilim adamı, Houston’daki Rice’ta danışmanı olan fizik ve biyomühendislik profesörü Michael Deem’di.

Bilim adamı He Jiankui, 18 Temmuz 2017 tarihinde Shenzhen, Çin’deki Direct Genomics şirketinde konuşuyor. Kaynak: Çin Stringer Ağı / Reuters / Newscom
HIV ve İKİZ BEBEKLER
He Jiankui, HIV için embriyo geninin düzenlenmesini seçtiğini çünkü HIV enfeksiyonlarının Çin’de büyük bir sorun olduğunu söyledi. Aynı zamanda erken bir embriyodan yani az sayıda hücre varken başlangıçtan başlamak genom düzenlemek için daha iyi bir yaklaşımdır. He Jiankui AIDS* ‘e neden olan virüs HIV’in hücreye girmesine izin veren bir protein kapısı oluşturan CCR5 adında bir geni devre dışı bırakmaya çalıştı.
AIDS (Edinilmiş Bağışıklık Yetersizliği Sendromu) : Vücudun bağışıklık sistemini zayıflatan, enfeksiyonlara ve bazı kanserlere karşı direnci büyük ölçüde azaltan bir hastalık. HIV virüsünden kaynaklanır.
AP fotoğraf / Kin Cheung
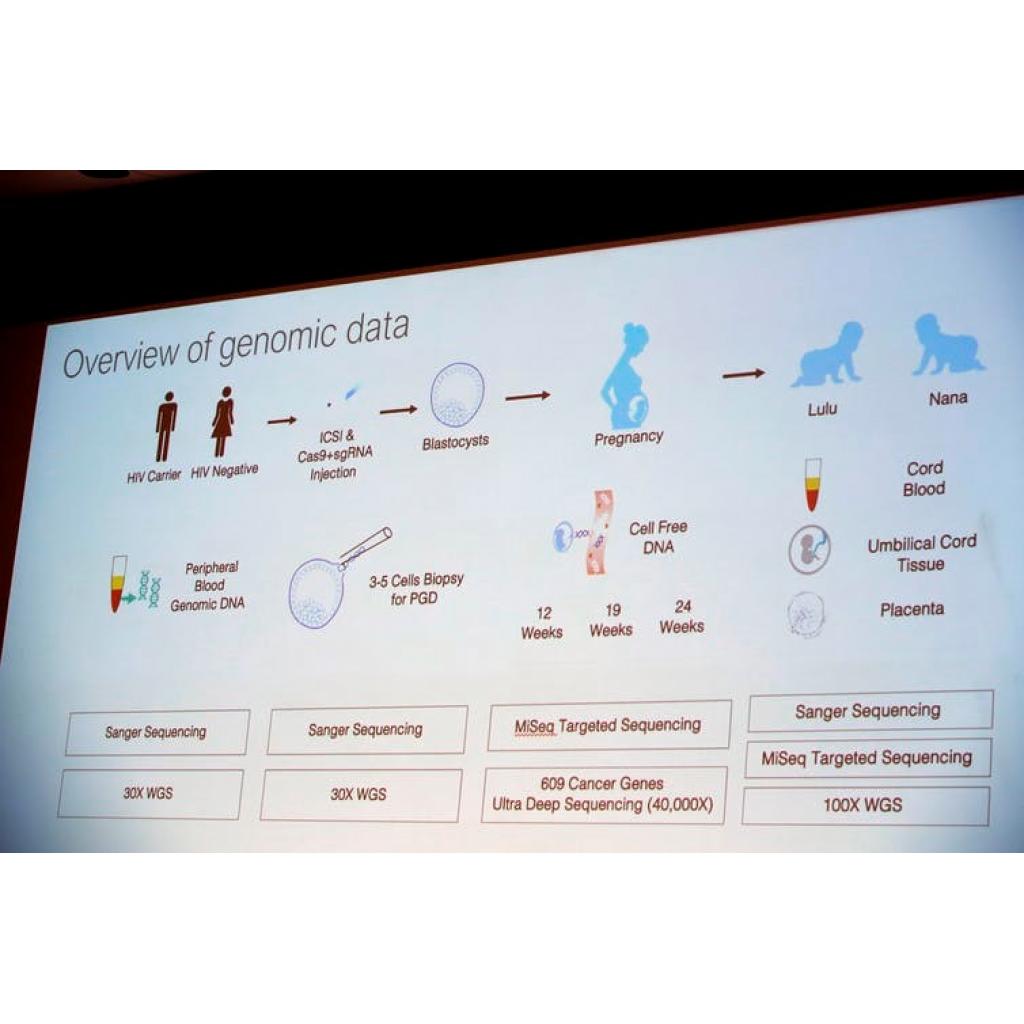
He JİANKU LULU VE NANA’NIN GENLERİNİ NASIL DÜZENLEDİ?
Çin’de HIV enfeksiyonu prevalansı yüksektir ve bu hastaların sağlık hizmetlerine erişimi ciddi bir halk sağlığı sorunudur. Jiankui bu durumu göz önüne alarak Baihualin adlı Pekin merkezli bir AIDS savunma grubu aracılığıyla çiftler topladı. Yayımlanan tıbbi belgeye göre, çalışma HIV negatif kadın partnerleri olan ve IVF* (in vitro fertilization ) programına katılmak isteyen ve embriyoların CRISPR ile düzenlenmelerine izin veren enfeksiyonları ilaç tedavisiyle büyük ölçüde bastırılmış HIV pozitif erkekleri seçti. He Jiankui’ye göre normal şartlarda bu ebeveynlerin çocukları AIDS hastası olarak doğacaklardı.
*IVF: İn vitro fertilizasyon ya da halk arasındaki adıyla tüp bebek; bir yumurtanın sperm tarafından, vücut dışında sunî olarak döllenmesi sürecidir.
He Jiankui’nin amacı HIV’den etkilenen çiftlere benzer bir kaderden koruyabilecekleri bir çocuğa sahip olma şansı sunmaktı.
Gen düzenlemesi, IVF veya laboratuvar kabı gübrelemesi sırasında meydana geldi. İlk olarak spermi HIV’in gizlenebildiği sıvı olan semenden ayırmak için sperm “yıkandı”. Bir embriyo oluşturmak için tek bir sperm tek bir yumurtaya yerleştirildi. Hücreler bölünmeye başlayıp embriyo 3-4 günlük hale gelince, embriyo dondurulup HIV virüsünün hücrelere girmesi için kritik olan kromozom 3’ün kısa kolu üzerinde bulunan CCR5 adlı bir geni embriyolardan çıkarmaya odaklanıldı. Bunun için gen düzenleme aracı(CRISPR-CAS9) kullanıldı. Embriyoların DNA’sı değiştirildi, moleküler makasın gerçekten hedefte oldukları doğrulandı ve analiz tamamlandığında, modifiye edilmiş embriyolar çözüldü ve en iyileri, gebeliğin gerçekleşmesi için annenin vücuduna yerleştirildi. Yani He Jiankui daha doğmamış çocuğa olumlu bir mutasyon uygulayarak hayatı boyunca AIDS hastalığına yakalanmasını önledi. Bu doğal mutasyon , ikizlerle birlikte yeni nesillere de geçebiliyor. Toplamda 22 embriyodan 16’sı düzenlendi ve ikiz gebelik elde edilmeden önce 6 yerleştirme denemesinde 11 embriyo kullanıldı. Ayrıca yayımlanan kaynaklar çiftler hamilelik girişimleri için düzenlenmiş veya düzenlenmemiş embriyoların kullanılıp kullanılmayacağını seçebilme şansına sahip olduğunu gösteriyor.
Juan Gaertner / Shutterstock.com
NEDEN ARAŞTIRMADA EMBRİYO KULLANILDI?
CHRİSTOPH BURGSTEDT / İSTOCK / GETTY IMAGES PLUS
Birçok uygulama için az hücreli aşamada genlerde değişiklik yapılması idealdir. Sonra, embriyo DNA’sını çoğalttığında ve hücre sayısını arttırmak için mitozla böldüğünde genetik modifikasyon da çoğaltılır. Bu, bebekteki her hücrenin genetik değişime sahip olması için devam eder.
LULU VE NANA’YA NE OLDU?
İkiz bebeklerin ve bu Temmuz 2019 sonunda doğması planlanan veya doğmuş ama gizliliği korunan 3. bebeğin devlet gözetimi altında tutulacağı söyleniyor.
ÇALIŞMANIN SONUCU
Bu çalışmanın sonuçları hakemli bir bilimsel dergide yayımlanmadı.He Jiankui çalışmanın sonuçlarını internet üzerinden bir sitede paylaştığı videolarla açıkladı. Videolarında özellikle tasarlanmış bebekler demenin yanlış olduğunun “genetik cerrahi ya da gen düzenlemesi” terimlerinin doğru olduğunun üstünde duruyor. Lulu ve Nana’nın da en az diğer bebekler kadar sağlıklı olduğunu, yaptıkları çalışmadan gurur duyduğunu ve bu çalışmanın yeni bir kapı araladığını da sözlerine ekliyor.
HE JİANKUİ
“Bozuk bir gen, kısırlık veya önlenebilir bir hastalık, hayatı söndürmemeli veya sevgi dolu bir çiftin birliğini baltalamamalıdır. Birkaç aile için erken gen cerrahisi, kalıtsal bir hastalığı iyileştirmenin ve bir çocuğu ömür boyu acı çekmekten kurtarmanın tek uygun yolu olabilir.Gen ameliyatı; estetik, geliştirme veya cinsiyet seçimi amacıyla veya çocuğun refahı, sevinci veya özgür iradesini tehlikeye sokacak herhangi bir şekilde asla kullanılmaması gereken ciddi bir tıbbi prosedürdür. Hiç kimsenin hastalığın önlenmesi dışında bir çocuğun genetiğini belirleme hakkı yoktur. Gen ameliyatı, çocuğu kalıcı olabilecek potansiyel risklerle karşı karşıya bırakır. Gen ameliyatı sadece ciddi bir tıbbi ihtiyaç risklere ağır bastığında yapılabilir. Bir yaşam fiziksel bedenimizden ve DNA’mızdan daha fazlasıdır. Gen ameliyatından sonra çocuğun özgürce yaşama , mesleğini, vatandaşlığını ve mahremiyetini seçme hakkı vardır. DNA’mız amacımızı veya başarabileceğimizi önceden belirlemez. Kendi çalışkanlığımız, beslenmemiz, toplumdan ve sevdiklerimizden desteğimiz bizi her daim ileretecektir. Genlerimiz ne olursa olsun, her bakımdan eşitiz. Zenginlik, sağlığı belirlememelidir. Genetik tedaviler geliştiren kuruluşların her kesimden aileye hizmet etmek için derin bir ahlaki zorunluluğu vardır.”
OLASI TEHLİKELER NELER?
CRISPR / Cas9, DNA’yı kesin konumlarda kesen moleküler bir makastır. Araştırmacılar, 2012’de tanıtılan gen düzenleme aracını, laboratuardaki sivrisinek popülasyonlarını düzenlemek, kirazların yetiştirilmesini kolaylaştırmak ve sayısız diğer hayvan ve bitkiyi değiştirmek için kullandılar. He Jiankui, CRISPR kullanarak iki bebekte DNA düzenlediğini bildirdi. Ancak araştırmacılar, aracın insanlarda kullanılacak kadar güvenli olmadığından hemfikirler.CRISPR-CAS9’un hedef dışı etkileri yani değişmesi istenmeyen diğer genleri değiştirmesi üzerindeki araştırmalar hala devam ediyor.

DNA ‘da düzenleme yapan bir bilim insanı(temsili)
ANDRİANO_CZ / İSTOCK.COM
İkizlerden birinde, CCR5 geninin her iki kopyasının da (hem anneden gelen hem de babadan gelen gen) değiştirildiği, diğeri için sadece bir kopya değiştirildiğini bazı kaynaklar yazmıştır. Bu durumda genetik modifikasyonun iki hücreli aşamaya veya sonrasına kadar gerçekleşmediği anlaşılıyor. Çünkü bebeklerdeki bazı hücrelerin modifikasyona sahip olduğu, diğerlerinin sahip olmadığı bulunmuştur. Bu duruma mozaikçilik denir. Çocuk normal ve düzenlenmiş hücrelerin mozaiğidir. Mozaikçilik riskinin , kanser , anormal organ gelişimi gibi beklenmedik ve zararlı sağlık etkilerine yol açabileceği ihtimali her zaman vardır. Bu durum insanlar üzerindeki gen çalışmalarını riskli kılar. Şu anda bu risklerin potansiyel faydalardan daha ağır bastığı ve devam etmeden önce daha temel araştırmaların yapılması gerektiği konusunda genel bir fikir birliği var. Faraler üzerinde yapılan çalışmalarla, CRISPR-CAS9’un istenmeyen yan etkiler bıraktığı gözlenmiş ve yayımlanan yeni makeleler ile bildirilmiştir.
Düzenleme mükemmel şekilde çalışsa bile, normal olarak CCR5 genleri olmayan insanların West Nile gibi bazı diğer virüsleri alma ve gripten ölme risklerinin daha yüksek olduğu da bulunmuştur.
Yapılan yeni çalışmalarla CRISPR bebeklerinde denenen genetik mutasyonun, erken ölüm riskinde artmaya neden olduğu bulunmuştur. Nature’da yayımlanan çalışma, CCR5-delta 32 olarak bilinen ve insanların küçük bir yüzdesinde doğal olarak oluşan bu mutasyonun, 76 yaşından önce ölüm riskinde % 20’lik bir artışa neden olduğunu bildirdi.
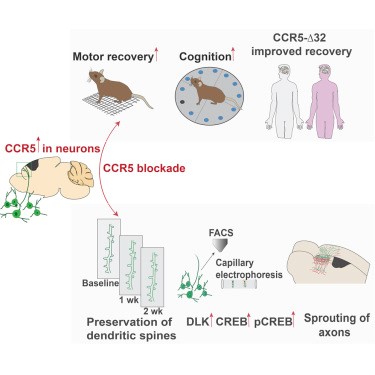
HIV İLACI FELÇ TEDAVİSİNDE YENİ BİR UMUT MU?
CCR5 genine sahip olmayan insanlar HIV’e direnç gösterirler. Maraviroc adlı bir HIV ilacı CCR5 reseptörünü bloke ederek çalışır. CCR5 geni, hücrelere CCR5 proteini oluşturmalarını söyler ve bu protein CCR5 reseptörüne bağlanır. Cell dergisinde 21 Şubat’ta yayınlanan yeni çalışmada araştırmacılar, Maraviroc’a CCR5 reseptörlerini bloke etmek için farelere verdiklerinde, farelerin yürüyüşlerinin ve uzuvlarının kontrolünü arttırdığını bulmuşlardı. Fareler inme yaşamamasına rağmen, bulgular hastalığa ışık tutabilir çünkü inme geçiren insanlar vücutlarının parçalarını hareket ettirmek ve kontrol etmekte zorluk çekerler.
Fakat sadece hayvanlarda bir şeyin etkisinin olması, insanlarda da aynı etkiye sahip olacağı anlamına gelmez. Bu nedenle CCR5 geninin insanlarda ve inmenin iyileşmesinde nasıl bir rol oynayabileceğini görmek için araştırmacılar, Tel Aviv Üniversitesi’ndeki hafif ve orta dereceli inme geçirmiş yaklaşık 450 hastanın iyileşmesini izleyen İsrailli bilim adamları ile işbirliği yaptı.
“Bu hastaların çoğunda doğuştan CCR5 geni yoktu.”
California Üniversitesi nöroloji profesörü ve başkanı, Dr. Thomas Carmichael
Araştırmacılar, genden yoksun olan hastaların hem fiziksel olarak hem de zihinsel olarak diğerleriyle karşılaştırıldığında daha iyi bir şekilde iyileşme sağladıklarını gördü.
Dr. Thomas Carmichael, CCR5’in yokluğunun iyi bir şey gibi görünmesine rağmen, genin bazı faydalar sağlayabileceğini de ekledi. Örneğin araştırmalar, anıların oluşumunu durdurmada önemli bir rol oynadığını göstermiştir.
Beyin hücre grupları bir uyaranı takip edip birbirine bağlandıklarında anılar oluşur.Bellek oluşumunu durdurmak için CCR5, bu hücre grubuna belirli bir uyaranla bağlantı kurmamalarını söyler. Örneğin; güzel güneşli bir günde en sevdiğiniz dondurmayı yiyorsunuz ama arkadan sürekli bir bebek ağlama sesi var. İşte CCR5 o an dondurma yerken gelen bebek ağlaması sesini, gelecekte hatırlamanızı engeller.
” Sonuçlar inme ve travmatik beyin hasarı sonrası iyileşmeyi teşvik etmek için yeni bir yaklaşım önerir. Ancak Maraviroc’un felçli hastaların iyileşmesi için bir tedavi olarak kullanılması, öncelikle bu özel amaç için ne kadar iyi çalıştığını doğrudan test eden bir klinik denemeden geçtikten sonra kabul edilecektir.”
Çalışmanın bir parçası olmayan NYU Langone Health’teki nöroepidemiyoloji direktörü Dr. Heidi Schambra
SONUÇ
Lulu ve Nana’daki gibi gen düzenlemesi sadece yetişkindeki kusurları tamir etmez. Sonsuza dek bir kişinin DNA’sını değiştirir. Daha sonra, bu düzenlenmiş DNA gelecek nesillere aktarılabilir.Yani bu ikiz kız çocukları HIV’e karşı yeni direnişlerini kendi çocuklarına da geçirebilirler. Onlar da kalıtımsal olarak her nesile bu değişimi miras bırakabilirler. DNA sarmal yapımızı açtığımızda bir hücredeki DNA uzunluğumuzun yaklaşık 2 metre olduğunu, toplam hücre sayımızın yaklaşık 30 trilyon olduğunu ve 200 farklı hücreye sahip olduğumuzu düşündüğümüzde her hücremiz bilinmezliklerle dolu.
Gelecek nesil üzerindeki öngörülemeyen etkiler tehlikeli ve etik dışı olabilir.Etik ihlal sonucu halk isyanı geleceğin umut verici bir tedavisin önüne geçebilir. En önemlisi de vücutta her sistem birbiriyle bağlantılı olduğundan en küçük bir zarar çığ etkisi yaratır.Gen çalışmalarında istemeyen genler üzerindeki etki genetik zarar bırakarak gelecek nesillerde kanser, organ işlev bozukluğu, zihinsel hasar ,immün sistem bozukluğu gibi ciddi rahatsızlıklar oluşturabilir. Ya da her organizma farklı olduğu için hayvanlar üzerindeki deneylerin sonuçlarının aynısını insanlar üzerinde göremeyebiliriz.Gen çalışması sayesinde HIV’ e karşı korunmuş bebekler, ileriki yıllarda CCR5 genleri olmadığı için daha ciddi bir hastalığa da yakalanabilirler. Ya da bu gen olmadığı için gelecekte ölümcül bir salgından da kurtulabilirler. Madalyonun iki yüzü var.Bu da kesin bilimsel kanıtlar üzerinden ilerlememiz gerektiğini gözler önüne serer.
Sonuç olarak gen cerrahisi pamuk ipliğine bağlı. Her an, yakın gelecekte veya uzun vadede istenmeyen sonuçlar oluşabilir. Bu vakadaki gibi olmaması koruyucu olduğu düşünülen bir gen ölümcül sonuçlar da doğurabilir. Tüm bu araştırmalar bize gösteriyor ki bu kadar karmaşık bir DNA ve gen sistemi üzerine bildiklerimiz çok kısıtlı. Bilim mükkemmel sonuçlar ışığında müthiş tedaviler yapabildiği gibi sonuçları tahmin dahi edilemeyen hasarlar da bırakabilir. Bilim iki ucu keskin bir bıçak. Tek dayanağımız daha fazla çalışmak, daha fazla araştırmak, ve daha fazla ilerlemek. Ve tüm bunları yaparken de olması gereken, sadece kendimizi düşünmek kesinlikle değildir. Tüm insanları en önemlisi de tüm doğayı, tüm gezegenimizi düşünmemiz gerektiğini aklımızdan çıkarmamamız gerekir. Çünkü doğa hasas bir denge halindedir. Bu dengeyi bozmadan ilerlememiz gerektiğinin bilincinde olmalıyız. En küçük bir zararda yine etkilenecek olan bizleriz. Bunun için de yere sağlam basıp yürümeli ve varsayımlar değil kesin bilimsel sonuçlar yolumuzu aydınlatmalıdır. Bilimin ışığı yolunuzu aydınlatırken, kalbiniz de sizi yalnız bırakmasın. SEVGİYLE KALIN.
KAYNAKÇA VE İLERİ OKUMA
- https://www.nature.com/articles/171737a0
- https://www.yourgenome.org/facts/what-is-crispr-cas9
- http://www.chictr.org.cn/showprojen.aspx?proj=32758
- https://www.nature.com/articles/s41594-019-0258-2
- https://science.sciencemag.org/content/364/6437/289
- https://www.nature.com/articles/s41591-019-0459-6
- https://doi.org/10.1016/j.cell.2019.01.044
- https://www.cell.com/cell/pdf/S0092-8674(19)30107-2.pdf