ALS (Amyotrofik Lateral Skleroz)

Giriş
Hepimizin aslında ünlü fizikçi Stephen Hawking’den aşina olduğu Amyotrofik Lateral Skleroz (ALS), motor nöronların hasar görmesi sonucu kasların güçsüz düşmesidir. Bu nedenle diğer adı Motor Nöron Hastalığı’dır [Motor Neuron Disease (MND)]. Hasta zaman geçtikçe kötüleşir. Önce kol ve bacaklarda, sonra tüm vücutta hareket zorlaşır. En sonunda nefes alma, konuşma ve yutma da güçleşir. Nadir bir hastalıktır ve bulaşıcı değildir. Her yıl 100 binde 2-6 kişide görülür. Net bir tedavisi yoktur, sadece hastalığın ilerlemesi geciktirilir. Ortalama yaşam ömrü hastalığın başlangıcından itibaren 4-6 yıldır. Ancak bazı hastalar 20 yıl yaşayabilir. Nörolojik hastalıklar arasında hasta başına düşen maliyetin en yüksek olduğu hastalıklardan biridir ve bu konuda sağlık kuruluşlarına büyük sorumluluk düşmektedir. Her yıl Amerika’da 6000 ALS hastası hayatını kaybetmektedir. 2040’larda ise dünya genelinde yaklaşık 400 bin kişinin bu hastalıktan hayatını kaybedeceği tahmin ediliyor. Bunun nedeni ise yaşlı nüfusun artmasır.
ALS çoğunlukla 40-60 yaşlarında görülür ve hastaların büyük kısmı erkektir. Yoğun fiziksel aktivite içeren mesleklerde hastalığın görülme olasılığı daha yüksektir. Sigara içenler de risk altındadır.
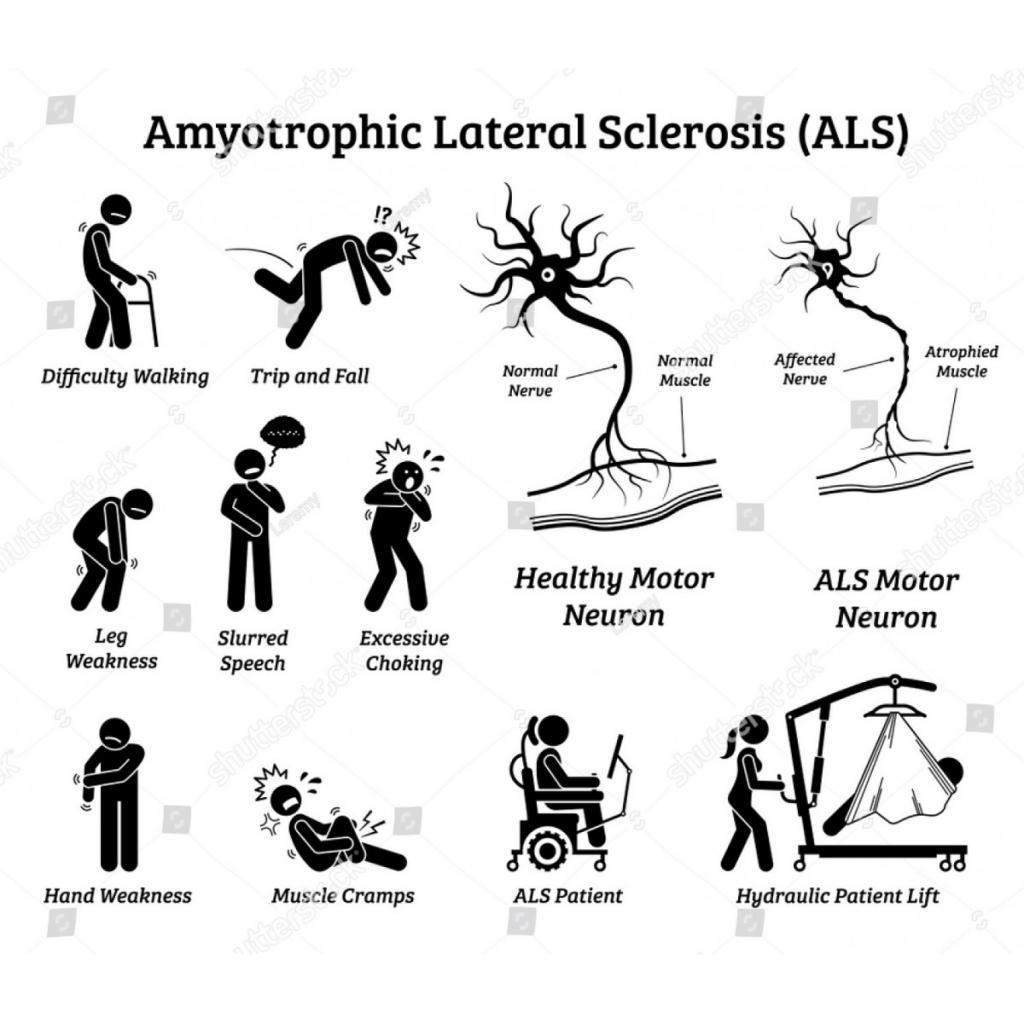
(Görsel Kaynağı: Leremy/Shutterstock, ID: 1312643564)
Hastalığın başlangıcı kişiden kişiye değişebilir. Genellikle kol ve bacaklarda kramp, sertlik ve seğirmelerle başlar ve bunu yutma ile konuşma güçlüğü takip eder. İlerleyen safhalarda yürüme bozukluğu, yürürken duraksama ve kalem ve bardak gibi nesneleri tutmada zorluk yaşanır. Hastaların %10’unda da solunum, konuşma ve yutmada kullanılan kaslar etkilenir. Son evrelerde kaslar çok eridiği için hasta yatağa düşer ve solunum cihazına gereksinim duyar. Fakat zeka, hafıza, bağırsak, mesane, duyular ve kalp kası etkilenmez. Göz kasları ya en son etkilenir ya da hiç etkilenmez. Kilo kaybı, yürürken yere düşme, yorgunluk, engellenemeyen gülme ve ağlamalar da görülür.
Tanı için ALS’ye özgü bir test yoktur. Elektromiyografi (EMG), kan ve idrar testleri, tiroid fonksiyon testi, kas ve sinir biyopsisi, röntgen, MR, lumbar ponksiyon (L3-4 vertebralar arasından iğneyle beyin-omurilik sıvısının alınması) gibi birçok işlem uygulanır. Hastalığı ortadan kaldıracak bir tedavi yok ancak yaşam kalitesini düzeltecek ve ömrü uzatacak tedaviler vardır. Semptomları azaltacak ilaçlar, fizik tedavi, yeme güçlüğünden dolayı ALS’lere özgü beslenme programı, konuşma terapisi; bilgisayar, solunum cihazı, havalı yatak, akülü tekerlekli sandalye, beslenme tüpü gibi çeşitli cihaz ve malzemelerle uyum tedavisi uygulanır. ALS’nin solunum cihazının bağlandığı son evresine kadar hasta kendine bakabilir. Süreç boyunca hastanın düzenli spor da yapması istenir.
Genetik Araştırmalar
Çeşitli çalışmalarda %90-95 kadar ALS hastasının ailesinde bir hastalık geçmişi bulunmamıştır. Buna sporadik ALS (sALS) denir. Kalan %5-10’luk kesiminse ailesinde ALS tespit edilmiştir. Buna da ailevi ALS (fALS) denir. Hastaların çoğunun sALS olmasının vücutta gerçekleşen çoklu reaksiyonlardan kaynaklandığı düşünülüyor. Bu reaksiyonlar genetiği de etkileyebilir.

İlk defa 1993’te Rosen et al. tarafından ALS’nin bir sebebi bulunmuştur. Buldukları süperoksit dismutaz-1 (SOD1)geni mutasyonudur ve fALS’lerin yaklaşık %20’sinin, sALS’lerin de yaklaşık %2’sinin nedenidir. SOD1 mutasyonu protein birikimine sebep olur. Birçok ALS’li hayvan üstünde yapılan çalışmada SOD1 geni mutasyonunun aksonal transport defektine yol açtığı görülmüştür. ALS’nin bir diğer nedeni KIF5A geninin mutasyonudur. Ancak bu mutasyon kalıtsal spastik parapleji (HSP) ve Charcot-Marie-Tooth’ta (CMT) olan KIF5A mutasyonundan farklıdır.
New York Genom Merkezi’nin yaptığı bir çalışmada 148 ALS hastasının korteksinden postmortem alınan örnekler 3 gruba ayrılmıştır. Örneklerin %61’inde retrotranspozon aktivasyonu ve TARDBP (TAR DNA Bağlayıcı Protein 43 / TDP-43) geni disfonksiyonu, %19’unda oksidatif stres ve %20’sinde baskın olarak glia aktivasyonu görülmüştür. Retrotranspozon, RNA’nın ters transkripsiyona uğrayarak DNA’ya eklenmeye çalışan şeklidir. TDP-43 proteini retrotranspozona bağlanarak DNA’ya eklenmesini ve böylece genomun değişmesini engeller. Ancak TDP-43 eksikliğinde retrotranspozonların sayısı artar ve bu hücre genetiğini olumsuz etkiler.
Normal bir nöron hücresinde TDP-43 proteini STMN-2 genindeki 2a bölgesini inhibe ederek Stathmin-2 (STMN2) poteinini üretir.
TDP-43 disfonksiyonu sonucu ALS bir hastanın nöron çekirdeğinde TDP-43 eksikliği ve sitoplazmik TDP-43 agregatları gözlenir. TDP-43 STMN2 genindeki 2a bölgesini inhibe etmediği için STMN2 proteini üretilmemektedir. Sonuç olarak hücre parçalanır.
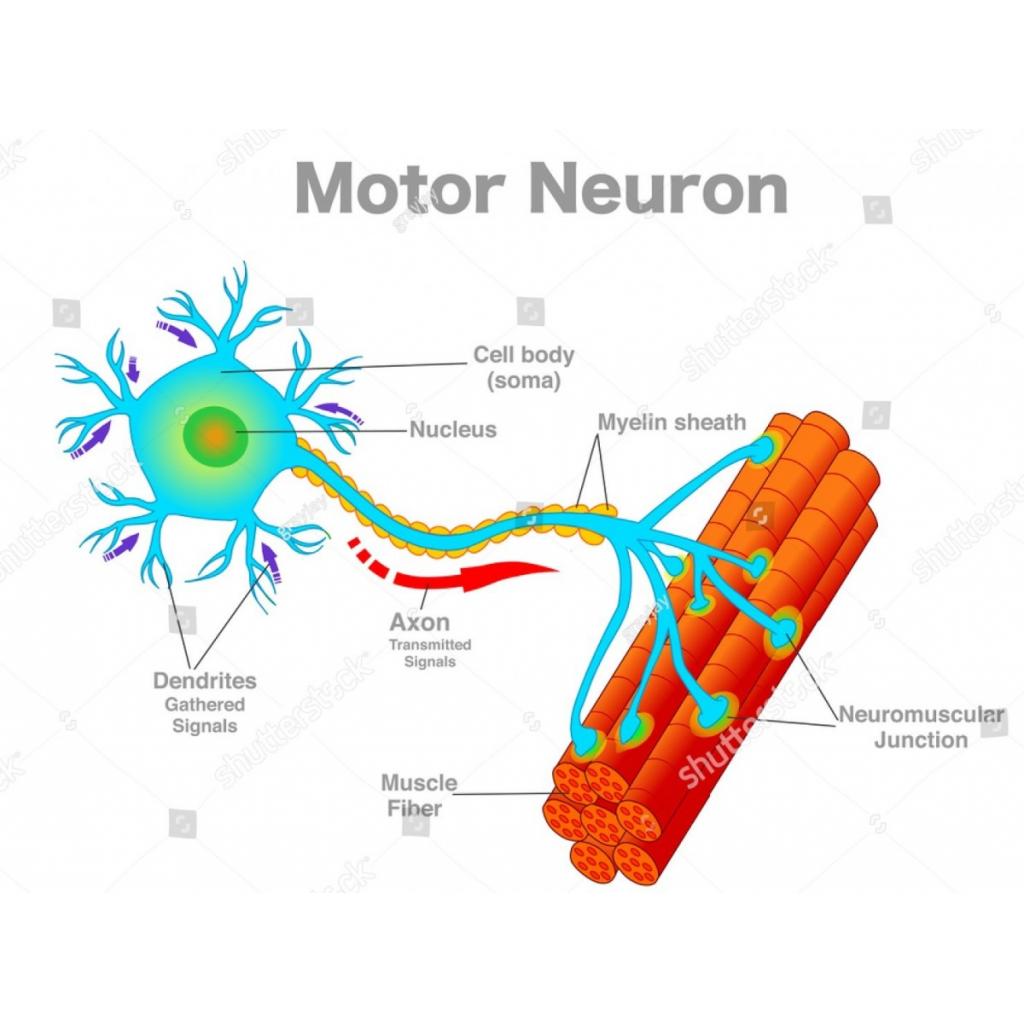
1629602293)
SOD1, C9ORF72, TDP-43 ve FUS genlerinde mutasyon sonucu nöron hücresinde oksidatif stres gerçekleşebilir. Mikroglialar inflamatuar aracı molekülleri salgılar ve astrositler hem hücre içine glutamat alamaz hem de toksik faktörler salgılar.
Oksidatif stres, glial aktivasyon, protein birikimi ve genetik bozukluklar dışında ER stresi, glutamaterjik sitotoksi, mitokondri bozuklukları ve aksonal transport bozukluğu da ALS’ye sebep olabilir. ALS’ye 1950 ve 1960’larda Japonya’nın Kii yarımadasında diğer ülkelere kıyasla 10 kat daha fazla rastlanıyordu ancak şu an diğer ülkelerle eşit durumda. Bu kademeli düşüşün sebebiyse bilinmiyor. Bu bölgenin çevresel özellikleri incelendiğinde içme suyundaki Kalsiyum ve Çinko’nun diğer bölgelerdeki sulardan daha az olduğu saptanmıştır. Buradaki ALS hastalarının serumlarında da Kalsiyum ve Çinko düşüktür. Saçlarında ise Mangan ve Vanadyum miktarı fazladır. İdrarlarında daha çok 8-hidroksi 2’-deoksiguanozin (8-OHdG) tespit edilmiştir. Bu molekül DNA oksidasyonunu gösterir. Ayrıca bu bireylerde serum miRNA tiplerinin miktarı da değişmektedir. ALS’ye sebep olan diğer genetik mutasyonlar C9ORF72, FUS/TLS, OPTN/FIP2, TBK-1, GRN, NEK1 ve C21ORF2 mutasyonlarıdır.
Bilgi Kaynakçası
- Acıbadem. Acıbadem Web ve Yayın Kurulu. 28.08.2019. https://www.acibadem.com.tr/ilgi-alani/als-amyotrofik-lateral-skleroz/
- ScienceDirect. Tam et al., 2019, Cell Reports 29, 1164–1177, October 29, 2019 ª 2019 The Author(s). https://doi.org/10.1016/j.celrep.2019.09.066
- ScienceDirect. Arakawa et al., Association between oxidative stress and microRNA expression pattern of ALS patients in the high-incidence area of the Kii Peninsula, Brain Research, 1746 (2020).
- ScienceDirect. Nicolas et al., Genome-wide Analyses Identify KIF5A as a Novel ALS Gene, Neuron (97):6, 1268-1283.e6 (2020).
- NCBI. Geon Chung, Chang. Lee, Hyosang. Bae Lee, Sung., Mechanisms of protein toxicity in neurodegenerative diseases, Cellular and Molecular Life Sciences 75:(17), 3159-3180 (2018).
Görsel Kaynakçası
- The World in HDR/Shutterstock
- Leremy/Shutterstock, ID: 1312643564
- BlueRingMedia/Shutterstock
- grayjav/Shutterstock, ID: 1629602293